
科目: 来源: 题型:
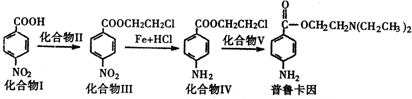
| 水 |
| NaOH |
| 水 |
| NaOH |
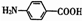 的一种同分异构体经氧化后也能得到上述化合物Ⅰ,该同分异构体的结构简式是
的一种同分异构体经氧化后也能得到上述化合物Ⅰ,该同分异构体的结构简式是

查看答案和解析>>
科目: 来源: 题型:
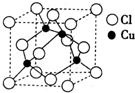 (2012?淄博一模)金属铜的导电性仅次于银,大量用于电气工业.
(2012?淄博一模)金属铜的导电性仅次于银,大量用于电气工业.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 (2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
(2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
| ||
| ||
| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:
(2012?淄博一模)常温下,有下列4种溶液:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com