
科目: 来源: 题型:



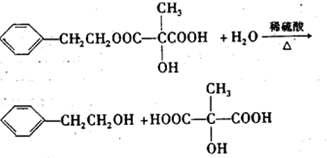



查看答案和解析>>
科目: 来源: 题型:
 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]查看答案和解析>>
科目: 来源: 题型:阅读理解
| 压强/Mpa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
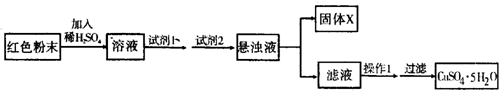
查看答案和解析>>
科目: 来源: 题型:


| 点燃 |
| 点燃 |
查看答案和解析>>
科目: 来源: 题型:
 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol查看答案和解析>>
科目: 来源: 题型:
(2010?宝鸡三模)几种短周期元素的原子半径及主要化合价见下表,下列叙述错误的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com