
科目: 来源: 题型:
A.方程式中化学计量数表示分子数
B.该反应ΔH大于零
C.该反应ΔH=-571.6 kJ· mol–1
D.该反应可表示36 g水分解时的热效应
查看答案和解析>>
科目: 来源: 题型:
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.碳酸铵分解是吸热反应,根据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
查看答案和解析>>
科目: 来源: 题型:
_____________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
当Qc=K时,反应处于平衡状态;当Qc<K时,反应向正反应方向进行;当Qc>K时,反应向逆反应方向进行。分析所给信息,思考下面的问题:
在密闭容器中进行的如下反应:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
SO2的起始浓度是0.4 mol ·L-1,O2的起始浓度是1 mol ·L-1。当SO2的转化率为80%时,反应达到平衡状态。
(1)求反应的平衡常数。
(2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动?
(3)若平衡时反应混合物的压强减小1倍,平衡将如何移动?
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动?
查看答案和解析>>
科目: 来源: 题型:
H2(g)+I2(g) ![]() 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
反应中各物质的浓度随时间变化情况如图2-18:
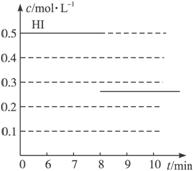
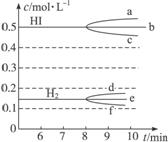

图2-18 图2-19 图2-20
(1)该反应的化学平衡常数表达式为______________________。
(2)根据图2-18数据,反应开始至达到平衡时,平均速率v(HI)为____________________ 。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K_______________(填写增大、减小或不变)。
HI浓度的变化正确的是__________(用图2-19中a—c的编号回答)。
②若加入I2,H2浓度的变化正确的是__________(用图2-19中d—f的编号回答)。
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图2-20中画出8分钟后HI浓度的变化情况。
查看答案和解析>>
科目: 来源: 题型:
(1)甲容器中反应的平均速率v(B)=__________,化学方程式中计量系数b=__________。
(2)乙容器中反应达到平衡所需要的时间t__________(填“大于”“小于”或“等于”)4 min,原因是_______________________________。
(3)T ℃时,在另一个体积与乙容器相同的丙容器中,为了使达到平衡时B的浓度仍然为0.8 mol·L-1,起始时,向容器中加入C、D的物质的量分别为3 mol 、2 mol,则还需加入A、B的物质的量分别是:______________________。
(4)若要使甲、乙两容器中B的平衡浓度相等,可以采取的措施是__________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器降低温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强都不变,向甲中加入一定量的B气体
查看答案和解析>>
科目: 来源: 题型:
Ca5(PO4)3OH(s)![]() 5Ca2++3
5Ca2++3![]() +OH-。
+OH-。
进食后,细菌和酶作用于食物,产生酸性物质,这时牙齿就会受到腐蚀,其原因是________________________________。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固。当牙膏中配有氟化物添加剂后能防止龋齿的原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com