
科目: 来源: 题型:阅读理解
2007年徐州市区空气质量良好以上天数达到了312天,成为近年来“蓝天”最多的一年。作为产煤较多和机动车数量快速增长的地区,徐州市区空气中二氧化硫和氮氧化物含量控制的任务依然艰巨。请回答下列问题:
 (1)燃烧化石燃料排放的烟气中含有NOX和S02。含有碱的黄磷乳浊液 能够同时去除NOX和S02,这是由美国科学家研发的,命名为
(1)燃烧化石燃料排放的烟气中含有NOX和S02。含有碱的黄磷乳浊液 能够同时去除NOX和S02,这是由美国科学家研发的,命名为
PhoSNOx法。在该方法最后阶段NO2--与HSO3--反应生成(NH4)2SO4
其离子方程式为 。
(2)工业上将S02转化为SO3是在接触室(如右图)里进行的,中部是一 个热交换器,它是用导热性能好的管状材料制成。温度低的气体A 从管外流过;经上层催化反应后的热气体从管内流过,通过导热材料进行气体与气体的热交换。 中学化学实验中也有许多需要进行热交换,下列实验中需要进行热交换的(直接加热除外)是 (填字母)。
A.粗盐的提纯 B.实验室制取少量蒸馏水
C.测定中和反应过程中溶液pH的变化
D.制取乙酸乙酯 E.酚醛树脂的制取
 (3)一定条件下,N02和S02很容易发生反应生成NO和SO3(g)。现将
(3)一定条件下,N02和S02很容易发生反应生成NO和SO3(g)。现将
NO和S02的混合气体通入容积为50 ml的容器中,充满后用带有导
管的塞子密封,则再向该容器中通入O2的体积V在 mL范
围内才能保持容器内的压强不变(设气体体积均在相同条件下测定,
且不考虑NO2转化为N204)。
(4)将盛有x molNO和y mol NO2的混合气(标准状况)的试管倒扣在足量
的水中,通入O2可以使水充满试管。请在右面的坐标图中大致画出不
断通人氧气的过程中溶液的pH与V(O2)的关系曲线(设生成的硝酸均在试管内)。
查看答案和解析>>
科目: 来源: 题型:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH
如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1) 从①组情况分析, HA是强酸还是弱酸 。
(2) ②组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3) 从③组实验结果分析,说明HX的电离程度______NaX的水解程度(选填“大于”、“小于”或 “等于”),
该混合溶液中离子浓度由大到小的顺序
是 。
(4) ①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能作近似计算:)。
c(Na+)-c(A-)= mol·L-1 ; c(OH-)-c(HA)= mol·L-1
查看答案和解析>>
科目: 来源: 题型:
海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
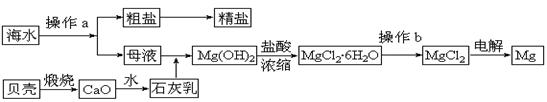
回答下列问题:
(1)流程图中操作a的名称为 。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是
。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②操作b是在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
 c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
试回答下列问题
(1)用苯和酒精擦拭铝片的目的: ,氢氧化钠溶液处理铝片的目的是: 。
(2)下列有关说法正确的是 (填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+ ![]() 2Al3+ +3H2↑
2Al3+ +3H2↑
(3)阴极的电极反应式为: 。
查看答案和解析>>
科目: 来源: 题型:
我国规定饮用水质量标准必须符合下列要求:
| pH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol·L-1 |
| 细菌总数 | <100个/mL |
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意
图如下:
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成,进而发生若干个化学反应,请写出其中任意一个反应的离子方程式 ?? 。
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是 ?? (填写序号)。
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是 ?? (填写化学式)。
(4)通入二氧化碳的目的是 ?? 和 ?? 。
(5)物质A的作用是 ?? ,则A可以选择下列物质中的 ?? (填写序号)。
①ClO2 ②SO2 ③液氯 ④Ca(ClO2)2 ⑤浓硫酸
查看答案和解析>>
科目: 来源: 题型:
风靡全球的饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸(PMLA)。
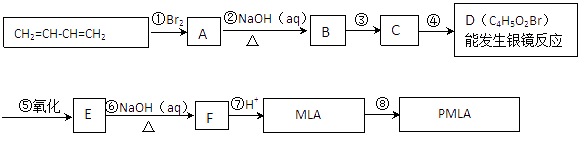
(1)写出下列物质的结构简式:A ,D 。
(2)指出反应类型:① ② 。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式: 。
(4)写出E→F转化的化学方程式 。
(5)上述转化关系中步骤③和④的顺序能否颠倒? (填“能”或“不能”)说明理由: 。
(6)PMLA具有良好的生物相容性,可望作为手术缝合线等材料应用于生物医药和生物材料领域。其在生物体内水解的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。


在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:
![]()
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
查看答案和解析>>
科目: 来源: 题型:
某氯碱厂日产50% NaOH溶液3000 kg。
(1)试计算该厂每天生产Cl2和H2的体积(标准状况)。
(2)如果把这些Cl2和H2都制成38%的盐酸,试计算理论上每天可生产盐酸的质量。
查看答案和解析>>
科目: 来源: 题型:
下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阴极
D.电解稀硫酸溶液制H2、O2时铜作阳极
查看答案和解析>>
科目: 来源: 题型:
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
![]() (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
![]() ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
![]() ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
![]()
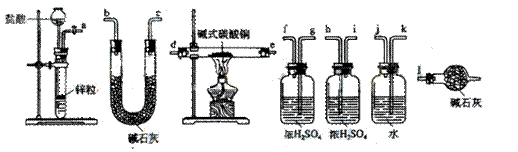 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
![]() (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com