
科目: 来源: 题型:
A、B、C、D、E分别为(NH4)2SO4、NH4Cl、NaCl、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合:
(1)A和B混合产生白色沉淀,加热后无明显变化;
(2)B和C混合产生白色沉淀,加热后产生使湿润红色石蕊试纸变蓝的气体;
(3)B和E混合无明显变化,加热后产生使湿润红色石蕊试纸变蓝的气体。
根据以上现象,判断A、B、C、D、E各为什么物质:
A , B ,C ,D E 。
查看答案和解析>>
科目: 来源: 题型:
利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
⑴染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 ▲ 。
⑵废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)= ▲ mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ▲ 。与方法一相比,方法二的优点为 ▲ 。
⑶三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
CCl2=CHCl +·Cl→·CCl2CHCl2
·CCl2CHCl2 + O2→·OOCCl2CHCl2
·OOCCl2CHCl2→·OCCl2CHCl2 + 1/2O2
·OCCl2CHCl2→CHCl2COCl +·Cl
该反应的总化学反应为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,将2mol A和2mol B两种气体相混合于体积为
2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() x C(g)+2D(g)
x C(g)+2D(g) ![]() H <0, 2min末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
H <0, 2min末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于 。
(2)计算该反应的化学平衡常数K= ,升高温度时K值
将 (选填“增大”、“减小”、“不变”)。
(3)A的物质的转化率为 。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为 mol;达新平衡时,A的物质的量为n(A)= mol。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若用惰性电极电解Y2+和Z2+共存的溶液时,Y先析出;又知M+X2+ ![]() M2++X。则这四种金属的活动性由强到弱的顺序为 ( )
M2++X。则这四种金属的活动性由强到弱的顺序为 ( )
A.X>Z>Y>M B.M >X> Z > Y C.M>Z>X>Y D.X>Z>M>Y
查看答案和解析>>
科目: 来源: 题型:
某教师在课堂上用如图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:
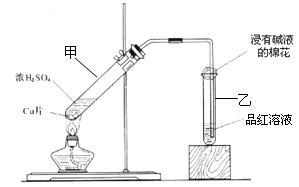
(1)试管乙中发生的现象是
该现象还能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
。
(3)试管乙口部浸有碱液的棉花的作用是 ,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)气体, (填“有”或“无”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
①该雨水中共溶解SO2的体积是 mL(标准状况)。
②若生成沉淀物的质量为4.50 g,则沉淀物的组成为 (填写化学式)。
查看答案和解析>>
科目: 来源: 题型:
下列有关Na2CO3和NaHCO3性质的说法中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.相同温度下,在水中Na2CO3的溶解度小于NaHCO3
C.106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3
D.Na2CO3 和NaHCO3均可与澄清石灰水反应
查看答案和解析>>
科目: 来源: 题型:
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB54 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方![]() 程式是 。
程式是 。
②![]() 某学生设计回收四氯化碳的操作步骤为:
某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取Wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:AtI+2Zn==ZnI2+ZnAt2 , AtI+2NH3(1)==NH4I+NH2At 。则下列叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
美日三名化学家[理查德·赫克(Richard Heck,美)、根岸荣—(Ei – ich Negishi,日)、铃木章(Akira Suzuki,日)利用钯(Pd)作催化剂,将有机化合物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为(R – X中的R通常是不饱和烃基或苯环;R′CH=CH通常是丙烯酸酯或丙烯腈等):
![]()
现有A、B、C、D等有机化合物有如下转化关系:

请回答下列问题:
(1)反应I的化学方程式为 。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加氢的化学方程式: 。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为
。
(4)写出B转化为C的化学方程式: 。
(5)D的结构简式为 。
(6)D具有化学性质有(填编号) 。
A.加热能与氢氧化钠溶液反应
B.能使溴的四氯化碳溶液褪色
C.能发生缩聚反应和加聚反应
D.能使酸性高锰酸钾溶液褪色
(7)已知:醛基直接与苯环连接的醛如![]() 不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式: 。
不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式: 。
①波谱分析显示分子中没有甲基;
②1,3,5—三取代苯;
③具有酸性,既能与Fe3+作用显色,又能使溴水褪色,易被新制的氢氧化铜氧化
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. 钠保存在煤油里的原因之一是它极易与氧气反应
B. 铝在空气中很容易燃烧
C. 镁表面的氧化膜疏松,不能保护内层金属
D. 铁锈的主要成分是Fe3O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com