
科目: 来源: 题型:
下列关于物质性质变化的比较中正确的是 ( )
①酸性:HClO4>HBrO??4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③热稳定性:HCl>H2S>PH??3 ④还原性:F—>Cl—>Br—
A.①②④ B.②③④ C.①②③ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
回答下列各小题:
(1)已知![]() 在水中的电离方程式为
在水中的电离方程式为![]() 。在
。在![]() 溶液
溶液![]() __________
__________![]() (填“>”“=”或“<”,1分)。
(填“>”“=”或“<”,1分)。

(2)常温下,向1.0mol/L的![]() 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的![]() 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________。
(3)在T℃时,将![]() 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K![]() 为__________,在该溶液中由水电离出的
为__________,在该溶液中由水电离出的![]() 为__________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的
为__________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的![]() 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________。
(4)0.1 mol·L-1pH为4的NaHB溶液中①![]() 、②
、②![]() 、③
、③![]() 由大到小的顺序为_______________。
由大到小的顺序为_______________。
(5)在0.1 mol·L-1的①![]() 溶液、②
溶液、②![]() 溶液、③
溶液、③![]() 溶液中,
溶液中,![]() 由大到小的排列顺序为_______________________。
由大到小的排列顺序为_______________________。
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏伽德罗常数,下列说法不正确的是
A.10g重水(D2O)中含有5NA个中子
B.N60分子中每个N原子均达到8电子稳定结构,则28gN60分子中含有共用电子对3NA个
C.标准状况下,15gNO和16gO2混合气体的体积约为22.4L
D.64gCaC2晶体中所含阴离子总个数为2NA
查看答案和解析>>
科目: 来源: 题型:
由短周期元素组成的中学常见无机物A、B、C、D、E、X,存在如在右图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
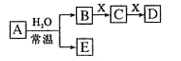
A.若X是![]() ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是![]() ,则E一定能还原
,则E一定能还原![]()
C.若D为CO,C能和E反应,则A一定为![]() ,其电子式是
,其电子式是![]()
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B原子的最外层电子数之和与C原子的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物常温下均为液态.请回答下列问题(填空时用实际物质的化学式表示):
(1)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式 ,其空间构型为 .
(2)科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 .
(3)C4分子结构如题26图所示,已知断裂lmol C-C吸收167kJ热量,生成1mo1C≡C放出942kJ热量.则下列说法正确的是 .

① C4属于一种新型的化合物 ② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量 ④ C2与C4互为同素异形体
⑤ C4与C2互为同分异构体
(4)已知A2(g)与C2(g)一定条件下反应生成0.5mol CA3(g)放出23kJ的热量,写出该反应的热化学方程式 .
(5)为了除去化合物乙(A2ED4)的稀溶液中混有的A2ED3,常加入氧化剂A2D2,发生反应的离子方程式为: .
查看答案和解析>>
科目: 来源: 题型:
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。
![]() II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。

(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
A.容器内的混合气体的平均相对分子质量不再变化
B.容器内的氮元素的质量不再变化
C.氢气的生成速率与氨气的消耗速率之比为2:3
![]() D.形成1mol N N键的同时形成6molN—H键
D.形成1mol N N键的同时形成6molN—H键
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。
查看答案和解析>>
科目: 来源: 题型:
下列有关物质分类或归纳的说法中,正确的一组是 ( )
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子
③明矾、石膏、冰醋酸、水都是电解质
④盐酸、漂白粉、水玻璃都是混合物
⑤分馏、干馏、裂化都是化学变化
⑥植物油、直馏汽油都可与溴水反应
A.①③⑤ B.②④⑥ C.①③④ D.②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
对A +3B![]() 2C +2D来说,下列四种不同情况下的反应速率最快的是
2C +2D来说,下列四种不同情况下的反应速率最快的是
A.υ(A)= 0.15 mol·(L·min)-1 B.υ(B)= 0.6 mol·(L·min)-1
C.υ(C)= 0.4 mol·(L·min)-1 D.υ(D)= 0.45 mol·(L·min)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com