
科目: 来源: 题型:
早在2004年,国家食品监督局就发出“警惕食品中丙烯酰胺(CH2=CHCONH2)”的公告,丙烯酰胺会在长期炸制食物过程中产生,具有中等毒性,它对人体可造成神经毒性和遗传毒性。已知:有机物H是丙烯酰胺的相邻同系物;A为气态烃,标准状况下密度为2.5g / L,其分子中有2个甲基;F为六元环状化合物。回答下列问题:

(1)写出G的结构简式__________________ K的结构简式_____________________
(2)指明下列反应类型:A→B:___________________E→G:___________________
(3)写出下列化学方程式:
C→D______________________________________________________________
E→F_______________________________________________________________
(4)下列关于丙烯酰胺的说法,不正确的是________(填选项序号)
①丙烯酰胺所有碳、氮原子不可能在一个平面内 ②人们应改善膳食习惯,少食油炸食品
③丙烯酰胺可发生加成和水解反应 ④酰胺类物质其实就是蛋白质
(5)写出有机物H所有同种类别的同分异构体的结构简式:
__________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(1);ΔH =-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应ΔH 1、ΔH 2、ΔH 3的关系正确的是 ( )
A.ΔH 1>ΔH 2>ΔH 3 B.ΔH 1<ΔH 3<ΔH 2
C.ΔH 1<ΔH 2<ΔH 3 D.ΔH 1>ΔH 3>ΔH 2
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。A、B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol·L—1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。 C的最高价氧化物的水化物是所有含氧酸中酸性最强的;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件回答:
(1)元素C位于第__________周期第__________族,它的最高价氧化物的水化物的化学式为____________。
(2)A元素是_______,B元素是______,D元素是______。(写元素符号)
(3)A与D形成的原子个数比为2:1的化合物的化学式是___ _ ____,
用电子式表示它的形成过程
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,
其离子方程式为______________________________ __________________。
查看答案和解析>>
科目: 来源: 题型:
1mol某烃A和1 mol苯完全燃烧,烃A比苯多消耗1mol O2,若A分子结构中无支链或侧链,则:(1)若A为环状化合物,它能与等物质的量的Br2发生加成反应,则A的结构简式为 ;
(2)若A为链状烯烃,1mol A最多可和2mol Br2发生加成反应且A与等物质的量的Br2加成后的可能产物只有2种,则A的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
关于炔烃的下列描述正确的是 ( )
A.通式为CnH2n-2的不饱和烃是炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃可以使溴水褪色,也可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
某溶液中含有NH4+、SO32-、SiO42-、Br-、CO32-、Na+,向该溶液中通人过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
A.①②③④ B.②③④ C.①③⑤ D.②④⑤
查看答案和解析>>
科目: 来源: 题型:
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 = 6HCl + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
查看答案和解析>>
科目: 来源: 题型:
以下实验方法能达到目的的是
A.皮肤上沾上少量苯酚可用稀NaOH溶液洗去
B.少量金属钠可保存在盛有乙醇的试剂瓶中
C.将海带灰用水浸泡,过滤后向滤液中通入氯气,用酒精可萃取出单质碘
D.仅通过物质间的相互反应即可鉴别出AlCl3、NaOH、HCl、NaCl四种溶液
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式与所述事实相符且正确的是
A.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
![]()
B.用稀硝酸清洗做过银镜反应的试管:![]()
C.向FeBr2溶液中通入过量的![]() :
:![]()
D.在强碱性溶液中,次氯酸钠将Mn2+氧化成Mn02:
![]()
查看答案和解析>>
科目: 来源: 题型:
硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆巩(CuSO4·5H2O)的生产流程示意图:
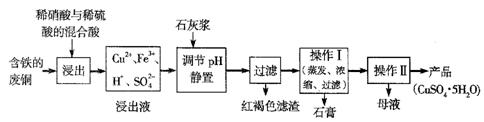
胆矾和石膏在不同温度下的溶解度(∥100g水)见下表。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
①红褐色滤渣的主要成分是
②写出浸出过程中生成硫酸铜的化学方程式 ;
③操作I的温度应该控制在 左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液 、 、洗涤、干燥。
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用
仪器和加热装置未画出)。
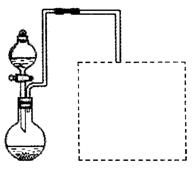
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内。该实验中对圆底烧瓶加热的最佳方式是 加热;
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com