
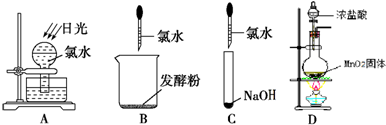
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 = 6HCl + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
(1)① (2分),FeI2 (1分),先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色(1分)
②黄绿色气体消失,产生白烟(1分),烧杯中的液体进入烧瓶中,形成喷泉(1分)
③将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体流下(1分)。
(2)①C(1分);
②Cl2+SO32-+H2O = 2Cl-+SO42-+2 H+(2分);
③ 过滤、洗涤、干燥(2分,少写1种扣1分,少写2种不得分);
④向废水中加入足量的盐酸(1分),将生成的气体先通入足量的 酸性KMnO4溶液,
通入澄清石灰水(1分),若紫色KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中
含有CO32-(1分)(若只加入盐酸没有使用氧化剂,则只能得1分)


科目:高中化学 来源: 题型:阅读理解
| 实验序号 | FeSO4溶液的体积读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 16.20 |
| 2 | 0.30 | 15.31 |
| 3 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com