
科目: 来源: 题型:
在密闭容器中,放入(NH4)2CO3和NaOH的混合物共ag,将容器加热至200℃,经充分反应后,排除其中的气体,冷却,称得剩余固体质量为bg,求容器中(NH4)2CO3和NaOH各多少克?
查看答案和解析>>
科目: 来源: 题型:
Na、Al混合物0.2 mol溶于足量盐酸,产生H2 3.136mL(S.T.P),求Na、Al的物质的量之比
A.1:2 B.1:3 C.1:1 D.4:1
查看答案和解析>>
科目: 来源: 题型:
某有机物的结构简式为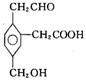 ,在一定条件下对于下列反应:①加成、
,在一定条件下对于下列反应:①加成、
②水解、③酯化、④氧化、⑤中和、⑥消去,其中该物质可能发生的是: ( )
A.②③④ B.①③⑤⑥ C.①③④⑤ D.②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
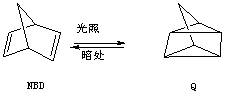 ;
;
以下叙述不正确的是( )
A.NBD的化学能比Q的化学能低
B.NBD和Q互为同分异构体
C.NBD能发生加成反应而Q不能
D.NBD不能使酸性KMnO4溶液褪色而Q能
查看答案和解析>>
科目: 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4中溶液,可与实验中
等4中溶液,可与实验中![]() 溶液起相似作用的是 ;
溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 {007} | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:
2010世界地球日的主题是:“珍惜地球资源 转变发展方式 倡导低碳生活”。下列活动不符合这一主题的是
A.用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.将工厂的烟囱造高,以减少工厂周围的大气污染
C.提高金属矿物利用率,减少金属用量,加强金属资源回收和再利用
D.改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的
做法,先开采和综合利用煤层气,然后再采煤
查看答案和解析>>
科目: 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
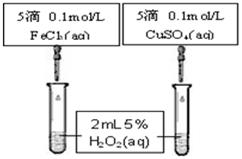
①可通过观察 来定性比较得出结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去)。请回答:

(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。

①装置Ⅱ中物质的化学式是 。
装置I中反应的化学方程式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是 ,所需仪器装置是
(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成。该反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl.3??6H2O晶体。(图中夹持及尾气处理装置均已略去)
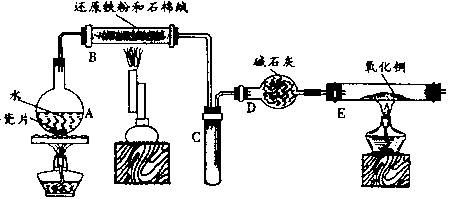
(1)装置B中发生反应的化学方程式是_________________________ ______;
(2)反应前向A中放入碎瓷片的目的是_______________________________,装置A、B、E、三处均需要加热,A、B、E三处加热的先后顺序是(用A、B、E表示) ;
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。向滤液中加入KSCN溶液,溶液不显红色,说明滤液中不含有![]() 离子,你认为滤液中不含有
离子,你认为滤液中不含有![]() 离子可能的原因是:__________________________________________。
离子可能的原因是:__________________________________________。
(4)该小组利用(3)中滤液制取FeCl3??6H2O晶体设计流程如下:
![]()
①步骤I若向100mL滤液中通入224mL Cl2(标准状况下)恰好完全反应,则原滤液中金属离子浓度约为__________mol/L。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_______________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合必要的离子方程式简要说明)
__________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com