
科目: 来源: 题型:
某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则该溶液中有的离子是( )
A. 一定溶解有SO42- B. 可能是SO42-,也可能是Ag+
C.一定溶有Ag+ D.一定溶解CO32-
查看答案和解析>>
科目: 来源: 题型:
对四种无色溶液进行检验,实验结果如下,其中明显错误的是( )
A.Cu2+,NO3-,OH-,HCO3- B.K+,Na+,Cl-,NO3
C.CO32-,OH-,Cl-,K+ D.NH4+,H+,Cl-,Al3+
查看答案和解析>>
科目: 来源: 题型:
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH-、Cl- B.Mg2+、Na+、SO42-、Cl-
C.Na+、Cu2+ 、SO42-、NO3 D.Ba2+、HCO3-、NO3-、K+
查看答案和解析>>
科目: 来源: 题型:
以下说法正确的是( )
A.还原剂中必定有一种元素被氧化
B.物质所含元素化合价升高的反应叫还原反应
C.在氧化还原反应中,失去电子的元素化合价降低
D.物质中某元素失去电子,则此物质是氧化剂
查看答案和解析>>
科目: 来源: 题型:
在100g浓度为18mol/L、密度为ρ的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积 ( )
A.等于100mL B.小于100mL
C.大于100mL D.等于![]() mL
mL
查看答案和解析>>
科目: 来源: 题型:
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图13所示。

(1)在0-30小时内,CH4的平均生成速率VⅠ、VⅡ和VⅢ从大到小的顺序为 ;
反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),该反应的△H=+206 kJ•mol-1
CO(g)+3H2(g),该反应的△H=+206 kJ•mol-1
将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
(3)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H=-802kJ•mol-1
写出由CO2生成CO的热化学方程式
查看答案和解析>>
科目: 来源: 题型:
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________;
(2)估算该离子反应的平衡常数__________
(3)在上述平衡体系中加入少量NaOH固体,平衡将向____反应方向移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向_____反应方向移动。
(5)下列事实不能用勒夏特列原理解释的是
A.碳酸钙不溶于水,但溶于盐酸。
B.对于2HI(g)![]() H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。
H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。
C.在实验室可用排饱和食盐水的方法收集氯气。
D.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
查看答案和解析>>
科目: 来源: 题型:
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g) ΔH = —148.9 kJ/mol
SiF4(g)+ 2H2O(g) ΔH = —148.9 kJ/mol
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
查看答案和解析>>
科目: 来源: 题型:
反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
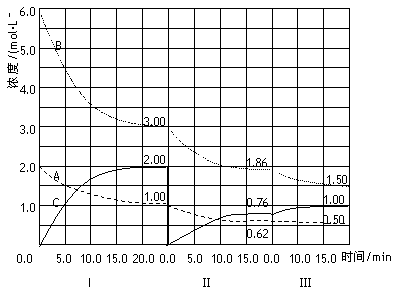
回答问题:
(1)反应的化学方程式中,a:b:c为_____________;
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为_________;
(3)B的平衡转化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是_____,其值是__________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是________________,采取的措施是____________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com