
科目: 来源: 题型:
(12分) 设反应①![]() 的平衡常数为
的平衡常数为![]() 。反应②
。反应②![]() 的平衡常数为
的平衡常数为![]() ,在不同温度下,
,在不同温度下,![]() 、
、![]() 的值如下:
的值如下:
| 温度 |
|
|
|
| 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③![]() 写出该反应的平衡常数K3的数学表达
写出该反应的平衡常数K3的数学表达
式:K![]() =____________。
=____________。
(3)根据反应①与②,可推导出K![]() 、K
、K![]() 与K
与K![]() 之间的关系式_______________。据
之间的关系式_______________。据
![]() 此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___________________
(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图l、2表示该反应③在时刻t![]() 达到平衡、在时刻t
达到平衡、在时刻t![]() 分别因改变某个条件而发生变化的
分别因改变某个条件而发生变化的
情况:
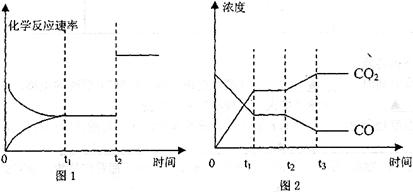
①图l中时刻t![]() 发生改变的条件是________________________________________
发生改变的条件是________________________________________
②图2中时刻t![]() 发生改变的条件是________________________________________
发生改变的条件是________________________________________
查看答案和解析>>
科目: 来源: 题型:
一定温度下的反应A(g)+3B(g)![]() 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内生成a mol A,同时生成3a mol B
D.C的生成速率与C的分解速率相等
查看答案和解析>>
科目: 来源: 题型:
下列事实不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。
B.对CO(g)+NO2(g) ![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深。
CO2(g)+NO(g),平衡体系增大压强可使颜色变深。
C.升高温度能够促进水的电离。
D.工业上合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施。
查看答案和解析>>
科目: 来源: 题型:
有一可逆反应 2A(g)+3B(g)![]() xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
⑴0.8 mol A、1.2 mol B、1.2 mol C ⑵1.4 mol A、2.1 mol B、0.6 mol C
达到平衡后,C的百分含量相等,则该化学方程式中x的值可能为
A.2 B.3 C.4 D.5
查看答案和解析>>
科目: 来源: 题型:
(12分)在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g)![]() 2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速度越快
(3)a与b的关系是:a b(填>、<、=)
(4)填写下表:
| 状态 条件 | 起始时物质的物质的量(mol) | 平衡时NH3的物质的量 (mol) | |||
| 编号 | X(N2) | Y(H2) | Z(NH3) | ||
| 恒容 | ① | 1 | 3 | 0 | b |
| ② | 0 | 0 | b | ||
| ③ | 2.25 | b | |||
查看答案和解析>>
科目: 来源: 题型:
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A.以X的反应速率为0.001 mol·L-1·s-1
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
在25℃时建立下列平衡:2NO2 ![]() N2O4+Q,若把烧瓶置于100℃的沸水中,下列情况:①颜色②平均摩尔质量③质量④压强⑤密度中不变的是
N2O4+Q,若把烧瓶置于100℃的沸水中,下列情况:①颜色②平均摩尔质量③质量④压强⑤密度中不变的是
A.③⑤ B.③④ C.②④ D.①③
查看答案和解析>>
科目: 来源: 题型:
两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,B中充入SO2和O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g)![]() 2SO3(g),对此反应,下述不正确的是
2SO3(g),对此反应,下述不正确的是
A.反应速率B>A B.SO2的转化率B>A
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
查看答案和解析>>
科目: 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
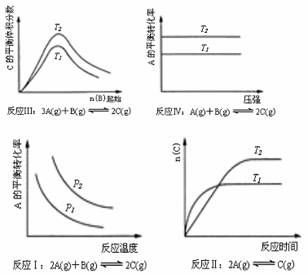
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com