
科目: 来源: 题型:
常温下,海水在浓缩过程中析出盐的种类和质量(表中为每升海水析出的各种盐的克数。单位g/L)如下:
| 海水密度 (g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.04 | 0.008 | |
| 1.22 | 0.015 | 90.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是:
A.各种盐的溶解度增大 B.海水中水的质量分数减小
C.析出的粗盐中 NaCl的质量分数增大 D.海水中Br-浓度不变
查看答案和解析>>
科目: 来源: 题型:
(10分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。
试回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。
你认为蒸馏法海水淡化最理想的能源是 ▲ 。
(2)从海水中可得到多种化工原料和产品。下列是海水资源利用的流程图。
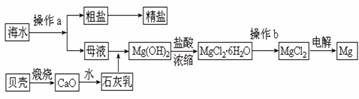
①流程图中操作a的名称为 ▲ 。
②工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。气体A、B是CO2或NH3,则气体B应是 ▲ 。(填化学式)
③镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
a.若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: ▲ 。
b.操作b是在 ▲ 气氛中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式 ▲ 。
c.在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳;②在海水中加入石灰乳,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中干燥晶体;⑤电解上述晶体的熔融物。
下列说法正确的是
A.镁元素在元素周期表中位于第三周期、ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是加快干燥速度
D.步骤⑤也可以采用电解该晶体水溶液的方法
查看答案和解析>>
科目: 来源: 题型:
(6分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 ▲ g/L
查看答案和解析>>
科目: 来源: 题型:
为了检验SO2中是否含有少量的CO2气体杂质,其下列操作正确的是 ( )
A. 先通入水中,再通入澄清石灰水中
B. 先通入品红溶液
C. 先通入酸性KMnO4溶液,再通入澄清石灰水中
D. 通入澄清石灰水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com