
科目: 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 _ 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 _ 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③![]()
![]() 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
_ (填物质序号),HCHO分子的立体结构为 _ 形。
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO _ FeO
(填“<”或“>”)。
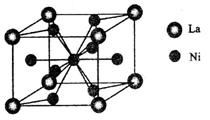
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 _ 。
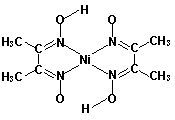
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右上图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
 | |||
 | |||
|
查看答案和解析>>
科目: 来源: 题型:
合成氨的发明是本世纪科学领域中最辉煌的成就之一。以下是与NH3相关的工业过程示意图。

已知:CH4(g) + 2O2(g) ==CO2(g)+2H2O(g)
△H = — 890kJ/mol
2CO(g) + O2(g) == 2CO2(g)
△H = — 566.0 kJ/mol
2H2(g) + O2(g) ==2H2O(g)
△H = — 571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g) 和H2(g)的热化学反应方程式:
_ 。
(2)生产中涉及H2和CO2的分离。你认为可取
的方法是(填代号) 。
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为: 。
(4)合成尿素的反应分两步进行:
①CO2(g)+ 2NH3(g)![]() H2NCOONH4(aq)△H = — 159.47kJ/mol
H2NCOONH4(aq)△H = — 159.47kJ/mol
(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
 在生产条件下,单位时间内获得尿素的产
在生产条件下,单位时间内获得尿素的产
量与压强和n(NH3):n(CO2)的关系如右图
所示。生产过程中n(NH3):n(CO2)的最佳
配比为 ,而实际生产往往使
n(NH3):n(CO2)≥3,这是因为
_ 。
在得到的尿素溶液中会含有少量的氨
基甲酸铵,除去这种杂质最简便的方法是 。
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3。若HNO3与NH3的反应是完全的,有标准状况下78.4LNH3经上述反应过程生成120g NH4NO3。则NH3转化为HNO3的转化率为 _ 。
查看答案和解析>>
科目: 来源: 题型:
含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
![]() 已知:
已知:
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
① 写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
② 用离子方程式表示溶液pH不能超过10的原因 。
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合成氢氧化物沉淀而除去。
① 写出阴极的电极反应式 。
② 电解法中加入氯化钠的作用是 。
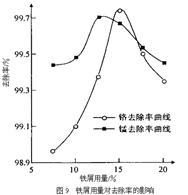
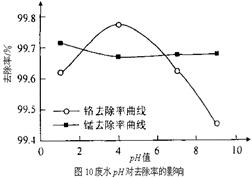
(3)某化学兴趣小组以含+6价铬和+2价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响。
① 取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图所示。则在pH一定时,废水中铁屑用量为 时,锰、铬去除率最好。
② 取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图10所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好。
查看答案和解析>>
科目: 来源: 题型:
新一代药物H具有良好的抗肿瘤活性,其合成路线如下:
| |
| |
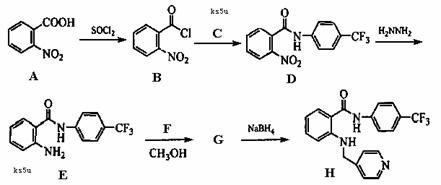
已知: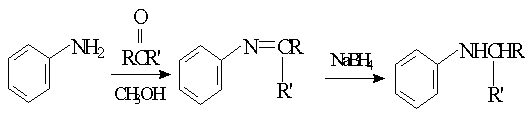
反应物中![]() R、R’可为:H、CH3、NH2等。
R、R’可为:H、CH3、NH2等。
(1)A→B的反应类型是 ,G→H的反应类型是 。
(2)已知B→D是取代反应,写出C的结构简式 。
(3)物质D所含官能团名称: 。
(4)写出E→G的反应方程式: 。
(5)写出符合下列条件的物质A的同分异构体的结构简式 。
①属于硝酸形成的酯 ②苯环上的一氯代物有两种
(6)苯并咪唑类化合物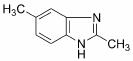 是一种抗癌、消炎药物。利用题给相关信息,以
是一种抗癌、消炎药物。利用题给相关信息,以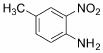 、CH3COCl、CH3OH为原料,合成过程中无机试剂任选;
、CH3COCl、CH3OH为原料,合成过程中无机试剂任选;
查看答案和解析>>
科目: 来源: 题型:
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
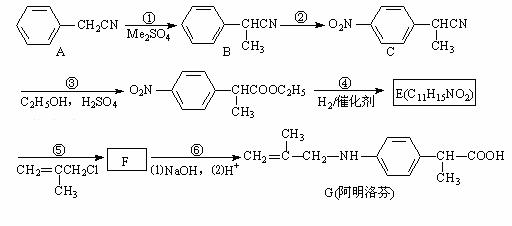
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示 。
(2)写出F的结构简式 。
阿明洛芬分子中含氧官能团的名称: 。
(3)反应③可以看成是两步反应的总反应,第一步是氰基(—CN)的完全水解反应生成羧基(—COOH),请写出第二步反应的化学方程式 。
(4)化合物E满足下列要求的同分异构体有 个。
①含有基团![]() ②含有对位二取代苯环
②含有对位二取代苯环
(5)阿司匹林也是一种抗炎镇痛药,可由水杨酸(邻羟基苯甲酸)和醋酸酐合成。请以邻羟基苯甲醇为有机原料设计合理步骤合成水杨酸(无机试剂任用)。(已知:苯酚易被氧化而苯酚钠难被氧化)。
合成路线流程图示例如下:
_
查看答案和解析>>
科目: 来源: 题型:
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电
池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为: 。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含三种元素,则其中心原子是 ,配位数
为________________。
查看答案和解析>>
科目: 来源: 题型:
工业上用CO生产甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g)。图5表示反应中能量的变化;图6表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是 ( )
CH3OH(g)。图5表示反应中能量的变化;图6表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是 ( )
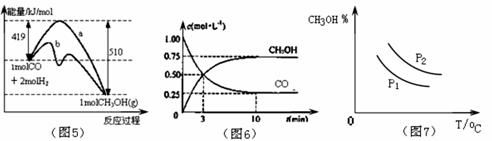
A.CO和H2合成CH3OH的反应:△H<0,△S>0。
B.图5中曲线b可表示使用了催化剂的能量变化情况
C.图7中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况
D.保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
查看答案和解析>>
科目: 来源: 题型:
下列溶液中有关微粒的物质的量浓度关系正确的是 ( )
A.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
B.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)>c(HRO3-)+c(RO32-)
C.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:
c(Na+)>c(Cl-)= c(CH3COOH)
D.常温下,将0.1mol·L-1NH4Cl溶液与0.05mol·L-1NaOH溶液等体积混合:
c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com