
科目: 来源: 题型:解答题
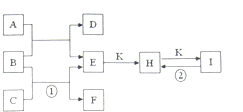 如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)
如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其他不溶于酸、碱的杂质.部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
| 沉淀物 | Al(OH)2 | Fe(OH)3 | Fe(OH))2 | Ni (OH)2 |
| PH | 5.2 | 3.2 | 9.7 | 9.2 |
欲从含镍废催化剂中制得NiSO4?7H2O晶体,其流程如下:
请根据以上信息和流程图,回答下列问题:
(1)“碱浸”的目的是除去含镍废催化剂中的______.
(2)“酸浸”时所加入的酸是_______.酸浸后,滤液②中可能含有的金属离子是______.(用离子符号表示).
(3)“调pH为2-3的目的是______.
(4)步骤A的操作顺序是加热浓缩、冷却、______、______.
(5)NiSO4在强碱溶液中用NaC1O氧化,可制得碱性镍镉电池电极材料NiOOH.该反应的离子方程式为______.
查看答案和解析>>
科目: 来源: 题型:单选题
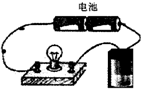 用如图所示的装置分别进行如下实验,各离子方程式书写正确且各组物质反应后溶液的导电性变化不大
用如图所示的装置分别进行如下实验,各离子方程式书写正确且各组物质反应后溶液的导电性变化不大查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com