
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:解答题
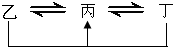 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com