
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
| 实验 | 现象 | 解释或结论 | |
| A | 加入FeCl3固体 | 溶液变成红褐色 | FeCl3的水解程度变大 |
| B | 加入等体积水 | 溶液颜色变浅 | c(Fe3+)变小 |
| C | 加入足量Fe粉 | 溶液颜色变浅绿色 | 2Fe3++Fe=3Fe2+ |
| D | 将FeCl3溶液微热 | 溶液变成红褐色 | 水解反应△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
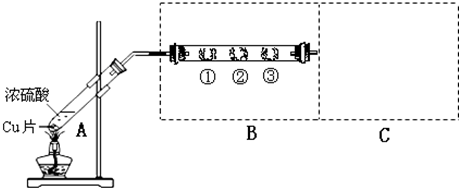
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 滴有酚酞的NaOH试液 | 品红溶液 | 淀粉和碘水混合液 |
| 现象 | ______ | ______ | ______ |
| 体现SO2的性质 | ______ | ______ | ______ |
查看答案和解析>>
科目: 来源: 题型:解答题
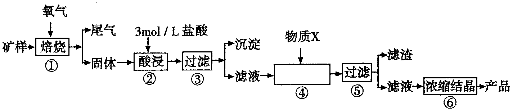
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
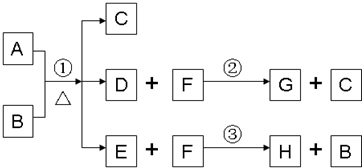
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是查看答案和解析>>
科目: 来源: 题型:解答题
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/100gH2O)见下表:
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
实验用品:10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为______,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用______洗涤晶体.
(4)称量生成的硫酸亚铁铵的质量,理论上为______g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com