|
试题详情
  D、CaO
Ca(OH)2溶液
NaOH溶液 D、CaO
Ca(OH)2溶液
NaOH溶液
试题详情
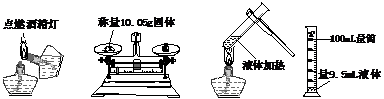
 17、在杠杆的两端分别挂着质量和体积都相同的 17、在杠杆的两端分别挂着质量和体积都相同的
铁球和铝球,这时杠杆平衡。将两球分别浸泡 在质量相同、溶质的质量分数也相同的稀硫酸 中(如图示),直至两个烧杯中均没有气泡产生 为止。两球的外型变化不大且无孔洞出现。下列推测中正确的是 A、铁球一定是空心的
B、拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计。下同) C、拿掉烧杯后,要想使杠杆平衡,支点应向N端移动 D、拿掉烧杯后,要想使杠杆平衡,支点应向M端移动 试题详情
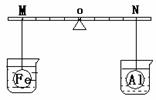
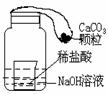
 18、要使右图装置中的小气球鼓起来,则使用的固体和液体可以是 18、要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①锌和稀硫酸;
②石灰石和盐酸; ③氯化钠和水;
④氧化钙和水。 A、①②③
B、①②④ C、②③④
D、①③④ 试题详情
19、M是一种活动性比铁强的金属,M离子(M2+)与其它几种离子构成化合物的溶解性见 下表: O2- OH- CO32- Cl一 SO42- NO3- M2+ 难溶 难溶 难溶 易溶 易溶 易溶 有下列各组物质:①M+HCl ②M(NO3)2+BaCl2 ③MO+HCl ④M(0H)2+NaCl ⑤M(0H)2+HCl ⑥M(NO3)2+HCl ⑦MCO3+HCl ⑧MSO4+BaCl2 其中不能直接反应制取MCl2的是 A、②④⑥ B、⑤⑥⑦⑧
C、①②④⑦ D、①③⑤⑧ 试题详情
20、下列各组稀溶液中,仅用同组稀溶液间的相互反应,就可以将其区别开的是 A、Na2CO3、HCl、HNO3、Na2SO4
B、K2CO3、H2SO4、HNO3、BaCl2 C、HCl、AgNO3、HNO3、NaCl
D、Na2SO4、NaOH、CuSO4、MgCl2 第Ⅱ卷 非选择题(共60分) 试题详情
三、填空题(第21题每空0.5分,其余每空1分,化学方程式每条2分,共31分 21、我们在初中化学里学过的一些物质,在实际生活中有重要的用途。现有以下物质: A.不锈钢; B.氧气; C.生石灰(氧化钙); D.活性炭; E.二氧化碳; F.水; G.醋酸; H.熟石灰(氢氧化钙);I.锌; J.盐酸。 请根据它们的用途,用字母代号填空(每种物质限选一次): (1) 可供急救病人呼吸; (6) 是最常用的溶剂; (2) 可用于制造炊具; (7) 可用来降低土壤的酸性; (3) 可用作温室气体肥料; (8) 可用于金属表面除锈; (4) 可用作某些食品的干燥剂;(9) 可用作干电池负极材料; (5) 可用作冰箱的除臭剂; (10)通常的食醋中含有约3%~5%的 。 试题详情
22、金属材料在生活中普遍使用。铁制品表面的锈要及时除去,这是因为铁锈 ,会加快铁制品的生锈。铝制品不需要除锈,这是因为铝表面能形成 ,可以阻止铝进一步氧化。 试题详情
23、2003年lO月15日,中国“神州五号”飞船载人航天取得成功。偏二甲肼是火箭推进器的常用燃料。根据偏二甲肼的化学式C2H6N2,你知道哪些信息?(即化学式表示的意义,回答不要求涉及相对原子质量。)请写出三点: (1)
; (2)
; (3)
。 试题详情
24、下列两个成语与我们所学的化学知识有关。请你任选一个,简述其中的化学原理。 A、百炼成钢(将反复烧红的生铁在空气中不断锤打,转化为钢。) B、釜底抽薪(釜:指古代炊具,相当于现在的锅;薪:指柴火。) 你选择的成语是
。其中的化学原理:
。 试题详情
25、2004年5月25日我市某地发生了一起亚硝酸钠中毒事件。亚硝酸钠外观酷似食盐且有咸味,亚硝酸钠和食盐的有关资料如下: 项 目 亚硝酸钠 (NaNO2) 氯化钠 (NaCl) 水溶性 试题详情
试题详情
易溶,在15℃时溶解度为35.8g 熔 点 271℃ 801℃ 沸 点 320℃会分解,放出有臭味的气体 1413℃ 跟稀盐酸作用 放出红棕色的气体NO2 无反应 (1) 根据上表请你写出亚硝酸钠的两条物理性质_______________、________________。 (2写出检验食盐中是否含有亚硝酸钠的过程
_____________________________
试题详情
26、某学习小组的同学,欲在不使用酸碱指示剂的条件下,通过添加试剂的方法将含有硝酸的硝酸钙溶液变为中性。甲同学提出选用石灰石粉末,乙同学提出选用澄清的石灰水。比较甲、乙两同学所选试剂,你认为
同学的选择不可行;理由是:该试剂虽然能除去原混合液中的
。 试题详情
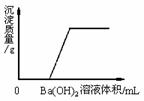 27、某溶液由NaOH、HCl、稀H2SO4和MgCl2中的一种或几种组 27、某溶液由NaOH、HCl、稀H2SO4和MgCl2中的一种或几种组
成。向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入 Ba(OH)2溶液体积的关系如下图所示。该溶液中不可能存在的物 质是__________,其理由是_______________________________ 试题详情
28、举例来证明下列结论是错误的: (1)金属都能和酸发生置换反应生成盐和氢气
。 (2)有盐和水生成的反应一定是中和反应
。 (3)物质的溶解度随着温度的升高都会增大
。 试题详情
 (4)原子团在化学反应中都作为一个整体参加反应,一定不发生变 (4)原子团在化学反应中都作为一个整体参加反应,一定不发生变
化________________________________________________。 试题详情
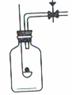
29、实验室用右图装置进行“质量守恒定律”的验证。依据实验 回答问题。 实验步骤:先将装置放在已调平衡的托盘天平上称量;然后取下装置,小心地 把碳酸钙颗粒加入稀盐酸中,待全部反应结束后,再称量装置的质量。 实验现象:
_________________________ 化学方程式:
_________________
___ 实验结论:
__________________________________。
试题详情
30、某同学为了研究竹子里面气体的成分,做了一个实验。 试题详情
 (1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出。然后采用
___________ 法(填实验室常用的一种集气方法)收集到了甲乙两瓶气体。 (1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出。然后采用
___________ 法(填实验室常用的一种集气方法)收集到了甲乙两瓶气体。
(2)将放有足量红磷的燃烧匙伸入甲瓶中(如图)。用放大镜聚焦,使红 磷燃烧,瓶内充满了白烟。然后,将甲瓶倒放水中,松开夹子,结果流 入的水约占瓶子容积的1/10。这说明竹子里的气体中肯定含有 _______________
; 试题详情
 (3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。 这说明竹子里的气体 (3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。 这说明竹子里的气体
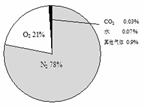
中肯定含有 ________________ ; (4)那么竹子里的气体含量与空气(空气中的气体含量如 图所示)有什么区别呢?于是,他又用空气重复了上述实 验。相比较后得出的结论是: _____________________ 。 试题详情
四、实验题(每空1分共19分) 31、某化学兴趣小组按以下步骤探究某一温度下氯化钠饱和溶液的酸碱度。 [ 猜想或假设 ] 溶液的pH可能为(请将你的假设填入空格中): ①pH < 7 ,②____________
,③____________ 。 [设计和实验 ] 要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的_________________(填序号)来进行实验。 ①pH试纸 ②紫色石蕊试液 ③酚酞试液 组内同学进行了如下实验: 甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试 纸显示的颜色与标准比色卡比较,测得pH=7。 乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸湿润,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。 丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。 [评价] 三位同学中操作规范的是_____________同学。指出其余同学操作上的错误 ___________________________________________________________ [结论和分析] 丙同学得出:“凡是盐溶液的pH都等于7”,你认为该结论是否正确?___________,如不正确请举一例说明(如正确,此空不用填)。________________________________________________________________。 试题详情
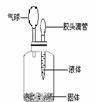
 32、利用左图装置进行A、B两组实验,将滴管a中的 32、利用左图装置进行A、B两组实验,将滴管a中的
少量溶液滴入b中,待完全反应后打开止水夹d。 试题详情
 a、b、c中的物质如下表所示,请填写表中的空格: a、b、c中的物质如下表所示,请填写表中的空格:
试题详情
33、在“空气中氧气含量的测定”实验探究中,甲生设计了如下实验方案: 试题详情
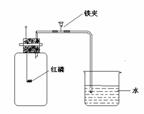 在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶。(实验装置如下图所示)回答下列问题: 在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶。(实验装置如下图所示)回答下列问题:
(1)实验过程中,观察到的主要现象是 ________
,
________
。反应的化学方程式是
。 (2)乙生用上述实验装置测定的结果是:空气中氧气含量与正常值有较明显的偏差,其操作上的原因可能是(要求答出两种):
________, (3)丙生也设计了一个实验方案,装置和操作同上,只不过用木炭代替了红磷。当木 炭停止燃烧,集气瓶冷却至室温,打开铁夹后,水能否进入集气瓶? 为什么?
(4)若仍然用木炭代替红磷,丙生的实验方案应作何改进,才能保证实验成功?(只 需答出实验方案中须改进的地方) 五、计算题(本意包括2小题,共10分) 试题详情
34、学校研究学习小组想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。 (1)你认为能测出其铜的质量分数的是____________合金; 试题详情
(2)研究小组取该合金的粉末32.5g,与足量该盐酸充分反应,经测定,产生了0.4g气体,试通过计算求出该合金中铜的质量分数; (3)若想测出该盐酸的质量分数,你认为实验时,必须提供和测出的数据是_____(填序号) A、参加反应的合金质量
B、参加反应的稀盐酸的质量 C、参加反应的稀盐酸的体积和密度 D、产生气体的质量 试题详情
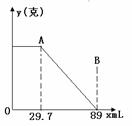 35、某固体物质由MgSO4和NaOH组成,取24克该固体混合物溶于水后,向所得的混合物中逐渐加入15%的硫酸(密度为1.1g/mL),发现沉淀量y与加入的硫酸的体积x有如图的关系。求该固体中MgSO4、NaOH的质量分数各为多少? 35、某固体物质由MgSO4和NaOH组成,取24克该固体混合物溶于水后,向所得的混合物中逐渐加入15%的硫酸(密度为1.1g/mL),发现沉淀量y与加入的硫酸的体积x有如图的关系。求该固体中MgSO4、NaOH的质量分数各为多少?
试题详情
| 

 A、6.0%
B、6.4% C、14.0% D、16.0%
A、6.0%
B、6.4% C、14.0% D、16.0%
 7、已知 CO2+2Mg
======2MgO+C,在实现图示的化学变化中,
7、已知 CO2+2Mg
======2MgO+C,在实现图示的化学变化中,
 属于氧化还原的是
属于氧化还原的是 A、Cu+4HNO3(浓)====Cu(NO3)2+2NO2 +2H2O
A、Cu+4HNO3(浓)====Cu(NO3)2+2NO2 +2H2O
 B、3Cu+8HNO3(稀)====3Cu(NO3)2+2NO +4H2O
B、3Cu+8HNO3(稀)====3Cu(NO3)2+2NO +4H2O D、Cu+2AgNO3====Cu(NO3)2+2Ag
D、Cu+2AgNO3====Cu(NO3)2+2Ag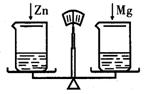 11、在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀
11、在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀 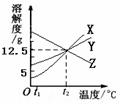 12、如图所示是X、Y、Z三种物质的溶解度曲线。在某温度下,把
12、如图所示是X、Y、Z三种物质的溶解度曲线。在某温度下,把