
科目:czhx 来源: 题型:阅读理解
| 点燃 |
| 点燃 |
| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50∽70 | 300∽550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
| 点燃 |
| 点燃 |
科目:czhx 来源: 题型:
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
科目:czhx 来源: 题型:阅读理解
| 实验次序 | 1 | 2 | 3 | 4 | 5 |
| H2O2溶液浓度 | 1% | 5% | 15% | 25% | 30% |
| 所用时间(秒) | 660 | 205 | 25 | 4 | 3 |
| 实验次序 | 1 | 2 | 3 | 4 | 5 |
| MnO2 粉末用量(克) | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
| 所用时间(秒) | 8 | 5 | 3 | 2 | 2 |
科目:czhx 来源: 题型:
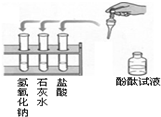 某中学九年级A、B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图 某中学九年级A、B两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示.实验后废液分别集中到废液缸中.某研究小组对此废液进行了检测,结果如下:
|
科目:czhx 来源: 题型:
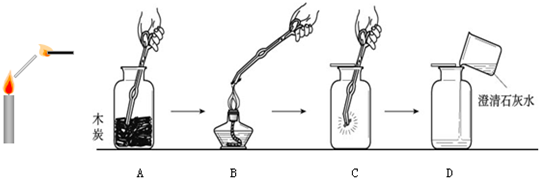
 某研究小组在学习氧气的化学性质时发现:铁丝、木炭燃烧没有火焰,蜡烛(主要成分是石蜡)燃烧却有明亮的火焰.该小组同学进行了如下探究.
某研究小组在学习氧气的化学性质时发现:铁丝、木炭燃烧没有火焰,蜡烛(主要成分是石蜡)燃烧却有明亮的火焰.该小组同学进行了如下探究.| MnO2 |
| MnO2 |
| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50∽70 | 300∽550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
科目:czhx 来源: 题型:
| 实验 序号 |
过氧化氢 溶液浓度/% |
过氧化氢 溶液体积/mL |
温度 /℃ |
二氧化锰 的用量/g |
收集氧气 的体积/mL |
反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
| MnO2 |
| MnO2 |
科目:czhx 来源: 题型:
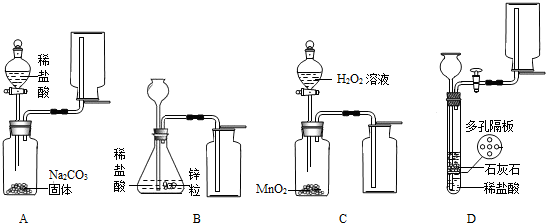
| ||
| ||
科目:czhx 来源: 题型:
| 实验步骤 | 实验现象 | 分析与解释 |
| (1)取少量氢氧化钠溶液于试管中, |
科目:czhx 来源: 题型:

科目:czhx 来源: 题型:阅读理解
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 |
有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
科目:czhx 来源: 题型:阅读理解
| 实验一:4mL 8%的CuSO4溶液 | 实验二:4mL 8%的CuCl2溶液 | |
| 实验现象 | 短时间无变化,数小时后铝片上仅有少量红色斑点 | 立即产生大量气泡,铝片上迅速有红色铜出现 |

科目:czhx 来源: 题型:
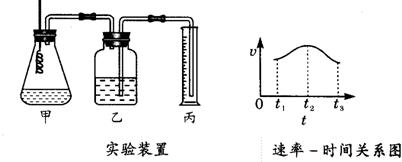
科目:czhx 来源: 题型:

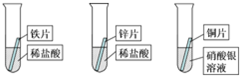
科目:czhx 来源: 题型:

| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 气体质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
科目:czhx 来源: 题型:
| 实验编号 | 1 | 2 | 3 | 平均值 |
| 生理盐水的体积(ml) | 65.0 | 65.0 | 65.0 | 65.0 |
| 硝酸银溶液的体积(ml) | 85.0 | 85.1 | 84.9 | 85.0 |
科目:czhx 来源: 题型:
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
科目:czhx 来源: 题型:

科目:czhx 来源: 题型:

科目:czhx 来源: 题型:
 某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰.该小组同学进行了如下探究.
某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰.该小组同学进行了如下探究.| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50∽70 | 300~550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |