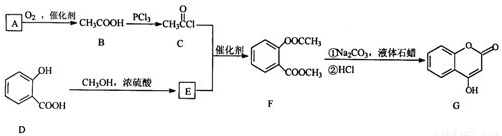
科目:gzhx 来源: 题型:
A. NH2D·H2O和 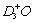 B. NH3·D2O和
B. NH3·D2O和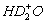
C.NH3·HDO和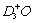 D.NH2D·H2O和H2D+O
D.NH2D·H2O和H2D+O
科目:gzhx 来源:物理教研室 题型:022
|
元素 |
最外层电子数 |
次外层电子数 |
|
D |
x |
x+4 |
|
E |
x+1 |
x+4 |
按要求填空:
(1)各元素的元素符号分别为:A________,B________,C________,D________,E________,F________。
(2)用电子式表示B和F形成化合物的过程:________。
(3)D的氢化物的化学式为________,E的氢化物的化学式为________,两者稳定性________>________。
(4)A和C两元素的最高价氧化物对应的水化物反应的离子方程式是________。
(5)把A的单质投入重水中,反应生成的氧化产物的化学式为________,还原剂为________,反应的离子方程式为________。
科目:gzhx 来源: 题型:
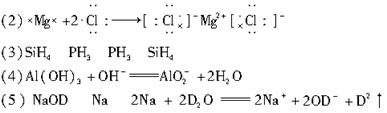
按要求填空:
(1)各元素的元素符号分别为:A ,B ,C ,D ,E ,F 。
(2)用电子式表示B和F形成化合物的过程: 。
(3)D的氢化物的化学式为 ,E的氢化物的化学式为 ,两者稳定性 > 。
(4)A和C两元素的最高价氧化物对应的水化物反应的离子方程式是 。
(5)把A的单质投入重水中,反应生成的氧化产物的化学式为 ,还原剂为 ,反应的离子方程式为 。
科目:gzhx 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学试卷(平行班)(解析版) 题型:选择题
NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均正确的是
A.NH2D·H2O和D3O+ B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+ D.NH2D·HDO和H2DO+
科目:gzhx 来源:同步题 题型:不定项选择题
科目:gzhx 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学试卷(平行班)(带解析) 题型:单选题
NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均正确的是
| A.NH2D·H2O和D3O+ | B.NH3·D2O和HD2O+ |
| C.NH3·HDO和D3O+ | D.NH2D·HDO和H2DO+ |
科目:gzhx 来源: 题型:阅读理解
| ||
| (一定条件) |
科目:gzhx 来源: 题型:阅读理解

| ||
| (一定条件) |
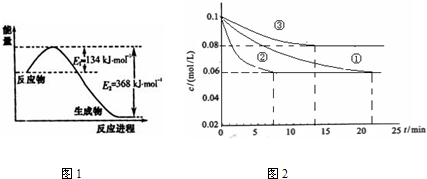
 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=| C(N2)•[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
科目:gzhx 来源: 题型:

| ||


| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
科目:gzhx 来源:2010-2011学年上海市十校高三下学期第二次联考化学试卷 题型:选择题
氯化铵晶体溶于重水中,溶液呈现出酸性,下列说法正确的是
A.NH4+水解生成NH3.H2O和HD2O+
B.NH4+水解生成NH3.DHO和H2DO+
C.NH4+水解生成NH3.D2O和H2DO+
D.NH4+水解生成NH3.DHO和D3O+
科目:gzhx 来源:2011-2012学年山东省潍坊市高三2月月考化学试卷 题型:选择题
下列描述违背化学原理的是( )
A.碳酸钠溶液显碱性,硫酸钠溶液显中性,可判断硫与碳的非金属活动性强弱
B.相同温度时,取物质的量浓度相同的盐酸和乙酸分别滴在PH试纸上,可判断
两者酸性强弱
C.NH4Cl溶于重水(D2O)中,反应生成的一水合氨和水合氢离子分别为NH3·HDO和等D3O+
D.高温时C能置换出SiO2中的Si,说明还原性C比Si强
科目:gzhx 来源: 题型:
A.![]() 水解生成NH3·H2O和HD2O+ B.
水解生成NH3·H2O和HD2O+ B.![]() 水解生成NH3·DHO和HD2O+
水解生成NH3·DHO和HD2O+
C.![]() 水解生成NH3·D2O和HD2O+ D.
水解生成NH3·D2O和HD2O+ D.![]() 水解生成NH3·DHO和D3O+
水解生成NH3·DHO和D3O+
科目:gzhx 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1 molCH4分子中共价键总数为NA
B.水的摩尔质量就是NA个水分子的质量之和
C.含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
科目:gzhx 来源:2010年安徽省高考化学练习试卷(一)(解析版) 题型:填空题
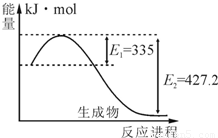
 2NH3,则在电化学合成氨的过程中,阴极反应式为 .
2NH3,则在电化学合成氨的过程中,阴极反应式为 . 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:、C(H2)、C(NH3)分别为平衡浓度)
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:、C(H2)、C(NH3)分别为平衡浓度)| t/K | 298 | 398 | 498 | … |
| K/-2 | 4.1×106 | K1 | K2 | … |
科目:gzhx 来源:不详 题型:填空题
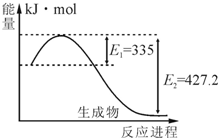
| ||
| (一定条件) |
| C(N2)•[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
科目:gzhx 来源: 题型:解答题
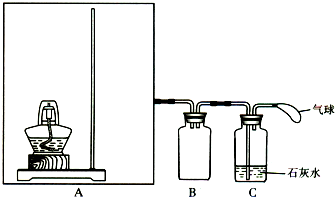
 Na2CO3+X,X的电子式是______.
Na2CO3+X,X的电子式是______.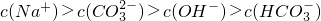
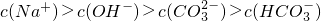
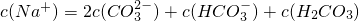
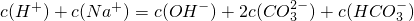
科目:gzhx 来源:山东省潍坊市重点中学2012届高三2月月考化学试题 题型:013
|
下列描述违背化学原理的是 | |
| [ ] | |
A. |
碳酸钠溶液显碱性,硫酸钠溶液显中性,可判断硫与碳的非金属活动性强弱 |
B. |
相同温度时,取物质的量浓度相同的盐酸和乙酸分别滴在PH试纸上,可判断 两者酸性强弱 |
C. |
NH4Cl溶于重水(D2O)中,反应生成的一水合氨和水合氢离子分别为NH3·HDO和等D3O+ |
D. |
高温时C能置换出SiO2中的Si,说明还原性C比Si强 |
科目:gzhx 来源:高中化学同步单元练习册第一册(高一年级) 题型:043
有A、B、C、D、E五种元素,它们的原子序数由A至E渐大.D的氢化物的分子式为 ;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等.A原子最外电子层有4个电子.B的阴离子与C的阳离子和氖原子的电子层结构相同.E原子的M电子层上共有7个电子.常温、常压下,B单质是气体,已知0.1mol的B单质与
;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等.A原子最外电子层有4个电子.B的阴离子与C的阳离子和氖原子的电子层结构相同.E原子的M电子层上共有7个电子.常温、常压下,B单质是气体,已知0.1mol的B单质与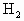 完全反应需2.408×
完全反应需2.408×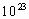 个氢原子.C单质在加热条件下与B单质反应生成淡黄色固体.根据上述情况,试回答下列各问题.
个氢原子.C单质在加热条件下与B单质反应生成淡黄色固体.根据上述情况,试回答下列各问题.
(1)A~E的元素符号分别为:________、________、________、________、________.
(2)C位于元素周期表中________周期、________族,其阳离子的结构示意图为________.
(3)D原子的电子式为________;E离子的符号为________.
(4)A元素与其余4种元素所能形成化合物的分子式为(仅限于由两元素组成)________、________、________、________.
(5)C单质和B单质在加热条件下生成化合物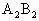 ,反应的化学方程式为________,反应中________为氧化剂;________为还原剂.
,反应的化学方程式为________,反应中________为氧化剂;________为还原剂.
(6)1.15g的C单质溶于50mL水中,所得溶液的质量分数为________.
科目:gzhx 来源:2011年四川省德阳市广汉中学高考化学练习试卷(解析版) 题型:填空题
 2NH3,
2NH3,