氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:

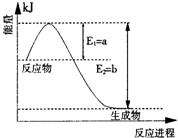
(1)如图是N
2和H
2反应生成2molNH
3过程中能量变化示意图,请计算每生成1molNH
3放出热量为
46.1kJ
46.1kJ
.
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递HH
+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N
2+3H
22NH
3,则在电化学合成氨的过程中,阴极反应式为
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.
(3)在固定体积的密闭容器中,进行如下化学反应:N
2(g)+3H
2(g)

2NH
3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
,C(N
2)、C(H
2)、C(NH
3)分别为平衡浓度)
| t/K |
298 |
398 |
498 |
… |
| K/(mol?L-1)-2 |
4.1×106 |
K1 |
K2 |
… |
请完成下列问题:
①试确定K
1的相对大小,K
1<
<
4.1×10
6(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是
C
C
(填序号字母).
A.容器内N
2、H
2、NH
3的浓度之比为1:3:2 B.2v(N
2)(正)=v(H
2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH
4Cl溶液呈酸性,这是由于NH
4+水解的缘故.则NH
4Cl溶于重水(D
2O)生成一水合氨和水合氢离子的化学式是
NH3?HDO和D3O+
NH3?HDO和D3O+
.
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为
B
B
A.C(Cl
-)>C(NH
4+)>C(H
+)>C(OH
-)
B.C(NH
4+)>C(Cl
-)>C(OH
-)>C(H
+)
C.C(Cl
-)>C(NH
4+)>C(OH
-)>C(H
+)
D.C(NH
4+)>C(Cl
-)>C(H
+)>C(OH
-)


 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=

 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.