
科目:gzhx 来源: 题型:
| [NO][SO3] |
| [NO2][SO2] |
| [NO][SO3] |
| [NO2][SO2] |
科目:gzhx 来源: 题型:
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程。

①按图所示将实验装置连接好。
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅。
回答下列问题:
(1)CaO与水反应的化学方程式为______________________________,该反应为________(填“吸热反应”或“放热反应”)。
(2)NH4NO3晶体溶于水温度________(填“升高”或“降低”)。NH4NO3溶于水________(填“是”或“不是”)吸热反应。
(3)查阅资料知NO2的平衡气体中存在的可逆反应为2NO2(g) ![]() N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”、“减小”或“不变化”)。混合气体的颜色不变______(填“能”或“不能”)证明反应已达平衡。
N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”、“减小”或“不变化”)。混合气体的颜色不变______(填“能”或“不能”)证明反应已达平衡。
科目:gzhx 来源:模拟题 题型:填空题
 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol 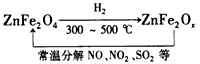
科目:gzhx 来源:高考三人行 化学 题型:013
下列可逆反应达到平衡时,增大压强和升高温度使平衡移动的方向相同的是
[ ]
A.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq);ΔH>0
HCl(aq)+HClO(aq);ΔH>0
B.2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
C.CO(g)+NO2(g)![]() CO2(g)+NO(g);ΔH<0
CO2(g)+NO(g);ΔH<0
D.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);ΔH<0
科目:gzhx 来源:2012年山东省济南市、滨州市高考化学一模试卷(解析版) 题型:解答题
科目:gzhx 来源:济南一模 题型:问答题
科目:gzhx 来源: 题型:
在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合会发生如下反应:
NO2(g)+SO2(g)![]() NO(g)+SO3(g)
NO(g)+SO3(g)
(1)该反应的平衡常数(K)表达式为_________________________。
(2)该可逆反应达到平衡的标志是 ![]() (填下列序号字母 )。
(填下列序号字母 )。
a. NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1∶1∶1∶1
b. 密闭容器的压强不再发生变化
c. K值不再发生变化
d. 生成n molSO2的同时,有n molSO3生成
(3)在上述平衡体系中通入少量O2,平衡 移动(填“向右”、“向左”或“不”之一);NO的浓度将 (填“增大”、“减小”或“不变”之一),c(NO)与c(NO2)之和 (填“增大”、“减小”或“不变”之一)。
(4)若10 min后容器内SO3气体质量为4g。则在10 min内用NO2浓度的变化表示反应的平均反应速率为________________ mol•(L•min)﹣1。
科目:gzhx 来源: 题型:
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为 。
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
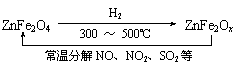
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x= 。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
科目:gzhx 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
(1)一定条件下,2SO2(g)+O2(g) 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO3 1.8 mol,则该可逆反应的平衡常数K=________;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g),重新达到平衡后,________mol<SO3<________mol.
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO3 1.8 mol,则该可逆反应的平衡常数K=________;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g),重新达到平衡后,________mol<SO3<________mol.
(2)用CH4催化还原NOx为N2可以消除氮氧化物的污染.现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为________.
(3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x=________.求可分解(2)中混合气体体积V(标准状况下).(写出计算过程)
科目:gzhx 来源: 题型:
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2L密闭容器中通人2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 50%(选填“>”、“<”或“=”)。
2SO3(g),向2L密闭容器中通人2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 50%(选填“>”、“<”或“=”)。
![]() ⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式: ,现有1L NO2、NO混合气体NOx将其还原成N2,需同温同压下CH4的体积0.
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式: ,现有1L NO2、NO混合气体NOx将其还原成N2,需同温同压下CH4的体积0.
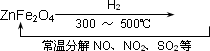
![]() ⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
![]()

![]() 若2mol ZnFe2Ox与SO2可生成0.75mol S,x= 。则可分解⑵中混和气体V= L。
若2mol ZnFe2Ox与SO2可生成0.75mol S,x= 。则可分解⑵中混和气体V= L。
科目:gzhx 来源:山东省月考题 题型:填空题
 NO(g)+SO3(g)
NO(g)+SO3(g) 科目:gzhx 来源:0110 期末题 题型:填空题
 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和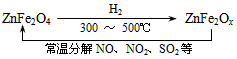
科目:gzhx 来源: 题型:
一定条件下,可逆反应NO2+CO![]() NO+CO2在容积不变的密闭容器中进行,当下列物理量不再随时间变化时,能说明该反应已达到平衡状态,该选项是 ( )
NO+CO2在容积不变的密闭容器中进行,当下列物理量不再随时间变化时,能说明该反应已达到平衡状态,该选项是 ( )
A.混合气体的压强
B.NO2的消耗速率与NO的生成速率之比
C.混合气体的颜色
D.混合气体的平均摩尔质量
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| A、该反应也可能需要催化剂 | B、该反应一旦发生将在很短的时间内完成 | C、该反应达平衡时至少有一种反应物的百分含量很小 | D、该反应的反应物混合后很不稳定 |
科目:gzhx 来源: 题型:
| A、K只与温度有关,温度不变,K不变 | B、改变条件,反应物的转化率增大,K也一定增大 | C、温度一定时,其正、逆反应的K相等 | D、若正反应△H<0,升高温度,该反应的K增大 |
科目:gzhx 来源: 题型:
| (2013•合肥一模)在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)⇔PCl5(g) 5min末达到平衡,有关数据如表.
|