
科目:gzhx 来源: 题型:
| A、硅是人类将太阳能转换为电能的常用材料 | B、粗硅制备单晶硅不涉及氧化还原反应 | C、石英玻璃和餐桌上的瓷盘都是硅酸盐制品 | D、盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
科目:gzhx 来源: 题型:
硅及其化合物的应用范围很广。下列说法正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.石英玻璃和餐桌上的瓷盘都是硅酸盐制品
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
硅及其化合物的应用范围很广。下列说法正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.石英玻璃和餐桌上的瓷盘都是硅酸盐制品
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:

| ||
| ||
科目:gzhx 来源: 题型:
| ||
| ||
科目:gzhx 来源:2011-2012学年广东省惠阳一中实验学校高一下学期3月月考化学试卷(带解析) 题型:填空题
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。
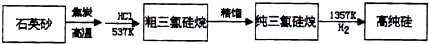
三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;
H2还原SiHCl3过程中若混入O2,可能引起的后果是
。
(2)下列有关硅材料的说法正确的是 (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
科目:gzhx 来源:2010届广州市高三理综化学测试卷 题型:填空题
(16分)硅单质及其化合物应用范围很广。请回答下列问题:
制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

(1)在制粗硅的反应中,焦炭的作用是 。
(2)整个制备过程必须严格控制无水、无氧。
①SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;②H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
科目:gzhx 来源: 题型:
硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450 ℃~500 ℃ 反应制得SiCl4
Ⅲ. SiCl4液体经精馏提纯后与过量H2在1100 ℃~1200 ℃ 反应制得纯硅
已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ。请回答下列问题:
① 第Ⅰ步制备粗硅的化学反应方程式为 ,第Ⅲ步反应的热化学方程式是 。
②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混O2,可能引起的后果是 。
(2)二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x= 。
科目:gzhx 来源: 题型:
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混入O2,可能引起的后果是 。
(2)下列有关硅材料的说法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
科目:gzhx 来源: 题型:
(16分)硅单质及其化合物应用范围很广。请回答下列问题:
制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
(1)在制粗硅的反应中,焦炭的作用是 。
(2)整个制备过程必须严格控制无水、无氧。
①SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;②H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
科目:gzhx 来源:2013学年江西省德兴一中、横峰中学、铅山一中、弋阳一中高一第三次月考化学试卷(带解析) 题型:填空题
(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷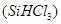 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 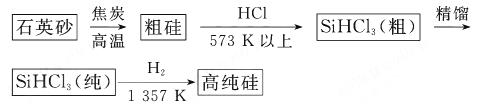
①写出由纯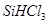 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。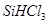 遇水剧烈反应生成
遇水剧烈反应生成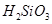 、HCl和另一种物质,配平后的化学反应方程式为 ;
、HCl和另一种物质,配平后的化学反应方程式为 ;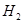 还原
还原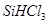 过程中若混入
过程中若混入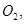 可能引起的后果是 。
可能引起的后果是 。
(2)下列有关硅材料的说法正确的是 (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
科目:gzhx 来源: 题型:
(08年广东卷)硅单质及其化合物应用范围很广。请回答下列问题:
制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____;H2还原SihCl3过程中若混02,可能引起的后果是______ 。
(2)下列有头硅材料的详法正确的是_____ (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水混
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.普通玻璃是由纯碱、石灰石和石英砂的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
E.盐酸可以和硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释_____。
科目:gzhx 来源: 题型:
硅单质及其化合物应用范围很广。请回答下列问题:三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。写出三硅酸镁与胃酸(盐酸)反应的化学方程式:
科目:gzhx 来源:2011届福建省厦门外国语学校高三11月月考化学试卷 题型:填空题
硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450 ℃~500 ℃ 反应制得SiCl4
Ⅲ. S iCl4液体经精馏提纯后与过量H2在1100 ℃~1200 ℃ 反应制得纯硅
iCl4液体经精馏提纯后与过量H2在1100 ℃~1200 ℃ 反应制得纯硅
已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ。请回答下列问题:
① 第Ⅰ步制备粗硅的化学反应方程式为 ,第Ⅲ步反应的热化学方程式是 
 。
。
②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混O2,可能引起的后果是 。
(2)二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x= 。
科目:gzhx 来源:2013学年江西省、铅山一中、弋阳一中高一第三次月考化学试卷(解析版) 题型:填空题
(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷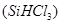 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
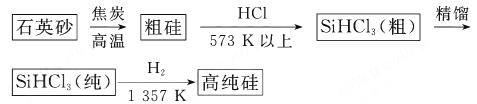
①写出由纯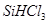 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。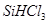 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和另一种物质,配平后的化学反应方程式为 ;
、HCl和另一种物质,配平后的化学反应方程式为 ;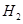 还原
还原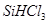 过程中若混入
过程中若混入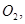 可能引起的后果是 。
可能引起的后果是 。
(2)下列有关硅材料的说法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释 。
科目:gzhx 来源: 题型:
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅 的主要方法,生产过程示意图如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
① 写出由纯SiHCl3制备高纯硅的化学反应方程式
________________________________________________________________________
________________________________________________________________________。
② 整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式
________________________________________________________________________;
H2还原SiHCl3过程中若混入O2,可能引起的后果是
________________________________________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液, 振荡。写出实验现象并给予解释:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
科目:gzhx 来源: 题型:
硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450 ℃~500 ℃ 反应制得SiCl4
Ⅲ. SiCl4液体经精馏提纯后与过量H2在1100 ℃~1200 ℃ 反应制得纯硅
已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ。请回答下列问题:
① 第Ⅰ步制备粗硅的化学反应方程式为 ,第Ⅲ步反应的热化学方程式是 。
②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混O2,可能引起的后果是 。
(2)二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x= 。
科目:gzhx 来源:2010-2011学年福建省高三11月月考化学试卷 题型:填空题
硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450 ℃~500 ℃ 反应制得SiCl4
Ⅲ. SiCl4液体经精馏提纯后与过量H2在1100 ℃~1200 ℃ 反应制得纯硅
已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ。请回答下列问题:
① 第Ⅰ步制备粗硅的化学反应方程式为 ,第Ⅲ步反应的热化学方程式是 。
②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混O2,可能引起的后果是 。
(2)二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x= 。