
科目:gzhx 来源: 题型:
| A、Na2CO3、Na2O2和O2 | B、Na2CO3、O2和H2O(g) | C、Na2CO3、NaOH、O2 | D、Na2CO3、NaOH、O2和H2O(g) |
科目:gzhx 来源: 题型:阅读理解

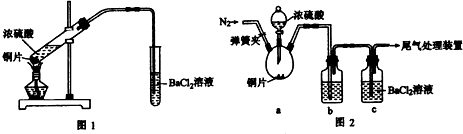
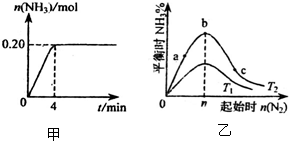
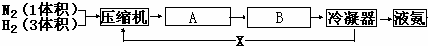 (1)写出设备A、B的名称:A
(1)写出设备A、B的名称:A科目:gzhx 来源: 题型:
| 催化剂 |
| 加热 |
| t/min | CH4(mol•L-1) | H2O(mol•L-1) | CO(mol•L-1) | H2(mol•L-1) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.3 |
| 3 | n1 | n2 | n3 | 0.3 |
| 4 | 0.09 | 0.19 | x | 0.33 |
科目:gzhx 来源: 题型:
 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:| 温度\压强 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
科目:gzhx 来源: 题型:
. |
| v |
科目:gzhx 来源: 题型:阅读理解
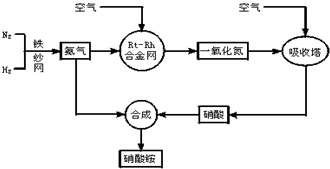
| ||
| ||
| C4(NO)•C6(H2O) |
| C4(NH3)•C5(O2) |
| C4(NO)•C6(H2O) |
| C4(NH3)•C5(O2) |
科目:gzhx 来源: 题型:
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
 合成氨反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g);△H=-92kJ/mol.向一个容积为2L的密闭容器中加入xmolN2和ymolH2,在一定条件下发生反应.
合成氨反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g);△H=-92kJ/mol.向一个容积为2L的密闭容器中加入xmolN2和ymolH2,在一定条件下发生反应.. |
| v |
| z |
| 10 |
| z |
| 10 |
科目:gzhx 来源: 题型:
. |
| v |
科目:gzhx 来源: 题型:
| A、Na2CO3、Na2O2和O2 | B、Na2CO3、O2和H2O(g) | C、Na2CO3、CO2、O2和H2O(g) | D、NaHCO3、Na2CO3和O2 |
科目:gzhx 来源: 题型:
| A、v(O2)=0.01mol/(L•s) | B、v(NO)=0.01 mol/(L•s) | C、v(H2O)=0.006mol/(L•s) | D、v(NH3)=0.005mol/(L•s) |
科目:gzhx 来源:2012-2013学年福建三明市泰宁县第一中学高一下第二阶段检测化学卷(带解析) 题型:单选题
温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
| A.v(NO)=0.08mol/(L•s) | B.v(O2)=0.01mol/(L•s) |
| C.v(NH3)=0.002mol/(L•s) | D.v(H2O)=0.004mol/(L•s) |
科目:gzhx 来源:2015届福建三明市高一下第二阶段检测化学卷(解析版) 题型:选择题
温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
A.v(NO)=0.08mol/(L?s) B.v(O2)=0.01mol/(L?s)
C.v(NH3)=0.002mol/(L?s) D.v(H2O)=0.004mol/(L?s)
科目:gzhx 来源:2012-2013学年浙江省杭州市高三上学期期中七校联考化学试卷(解析版) 题型:填空题
(14分)合成氨对化学工业和国防工业具有重要意义。
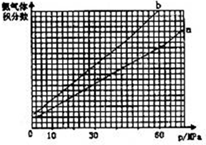
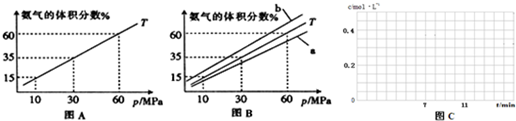
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
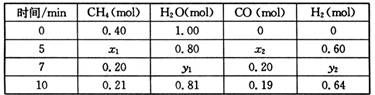
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
科目:gzhx 来源:2013届浙江省杭州市高三上学期期中七校联考化学试卷(带解析) 题型:填空题
(14分)合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: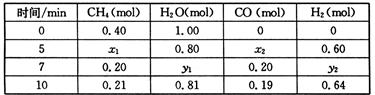
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
科目:gzhx 来源:2013-2014学年福建省高二上学期期中联考化学试卷(解析版) 题型:选择题
温度为500℃时,反应4NH3+5O2 4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
A.v(O2)=0.01mol/(L•s) B.v(NO)=0.01mol/(L•s)
C.v(H2O)=0.006mol/(L•s) D.v(NH3)=0.005mol/(L•s)
科目:gzhx 来源:2010—2011学年广东省揭阳一中高一上学期期末考试化学试卷 题型:填空题
(6分)有人在研究硫酸亚铁受热分解反应时,作了两种假设:
⑴假设它按氯酸钾受热分解的方式来分解,反应的化学方程式为:
⑵假设它按碳酸钙受热分解的方式来分解,反应的化学方程式为:
⑶事实上,硫酸亚铁分解为氧化铁,二氧化硫,三氧化硫(分解温度为500℃左右),则反应化学方程式为:
科目:gzhx 来源: 题型:
(6分)有人在研究硫酸亚铁受热分解反应时,作了两种假设:
⑴假设它按氯酸钾受热分解的方式来分解,反应的化学方程式为:
⑵假设它按碳酸钙受热分解的方式来分解,反应的化学方程式为:
⑶事实上,硫酸亚铁分解为氧化铁,二氧化硫,三氧化硫(分解温度为500℃左右),则反应化学方程式为: