
科目:gzhx 来源:高中化学同步单元练习册第一册(高一年级) 题型:038
将一定质量的Zn与100mL18.5mol/L浓 充分反应,Zn完全溶解,同时生成气体33.6L(标准状况),将反应后的溶液稀释至1L,测得溶液中
充分反应,Zn完全溶解,同时生成气体33.6L(标准状况),将反应后的溶液稀释至1L,测得溶液中 离子物质的量浓度为0.1mol/L,求气体A的各组分的体积比?
离子物质的量浓度为0.1mol/L,求气体A的各组分的体积比?
科目:gzhx 来源:2011-2012学年浙江省高三上学期第二次统练化学试卷 题型:填空题
(14分).下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
|
原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的, 写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
科目:gzhx 来源: 题型:
(14分).下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | -3,+5 | +2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的, 写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
科目:gzhx 来源:2015届天津市高一第一次月考化学试卷(解析版) 题型:填空题
(15分)(1)3.01×1022个OH¯的物质的量为 ;这些OH¯与 molNH3的质量相等,与 g Na+含有的离子数相同。
(2)在标准状况下,2.24LNOx气体的质量为4.6g,则x的值为 。
(3)有四种正盐的混合溶液,含有0.2 mol·L-1 Na+、0.25 mol·L-1 Mg2+、0.4mol·L-1
Cl-,则SO 的浓度为
的浓度为
(4)、用14.2g硫酸钠配制成500mL溶液,其物质的量浓度为 mol/L。若从中取出50mL,其物质的量浓度为 mol/L,溶液中含Na+的个数为
若将这50mL溶液用水稀释到100mL, SO42-的物质的量浓度为 mol/L。
科目:gzhx 来源:2013届浙江省宁波市高一上学期期末考试化学试卷 题型:计算题
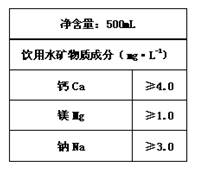
(1)矿泉水中往往含多种有益于人体健康的成分。右图是某品牌矿泉水中标签上的部分内容,则这瓶矿泉水中含Ca2+的物质的量≥ ▲ mol。

(2)现代生活离不开铝,工业上以铝土矿为原料生产铝。
现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500 mL溶液。取
100 mL该溶液,测得其中含有H+、Cl-、Mg2+、Al3+、Fe3+五种离子(不考虑其它离子)。
已知部分离子的物质的量浓度为:
c(H+) = 0.02 mol·L-1 c(Mg2+) = 0.01 mol·L-1
c(Fe3+)= 0.02 mol·L-1 c(Cl-) = 0.52 mol·L-1
①溶液中Al3+物质的量浓度为 ▲ mol·L-1k*s5*u
②则该铝土矿样品中Al2O3的质量为 ▲ g(精确至0.01 g)。
科目:gzhx 来源:2012届内蒙古巴彦淖尔市高三期中考试化学试卷 题型:填空题
(6分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及其物质的量浓度,进行以下实验:
①量取25.00ml甲溶液,向其中缓慢滴入乙溶液15.00ml,共收集到224ml(标准状况)气体。②量取15.00ml乙溶液,向其中缓慢滴入甲溶液25.00ml,共收集到112ml(标准状况)气体。
⑴判断:甲是 溶液,其物质的量浓度为 mol/L。
乙是 溶液,其物质的量浓度为 mol/L。
⑵实验②中所发生反应的离子方程式为 。
科目:gzhx 来源:2014届湖北省高一上学期期末考试化学试卷(解析版) 题型:选择题
向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的总物质的量和加入混合溶液B的体积关系如图所示:

(1)当加入B溶液110 mL时,溶液中的沉淀是 。(填化学式)
(2)从90 mL至100 mL之间加入10 mLB溶液时,由图像纵坐标不变可知此段发生反应的离子方程式是:① ;② ;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为 。
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为 mol/L;
A溶液中FeCl3物质的量浓度为 mol/L。
科目:gzhx 来源: 题型:
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
科目:gzhx 来源:2010-2011学年浙江省宁波市高一上学期期末考试化学试卷 题型:计算题
(1)矿泉水中往往含多种有益于人体健康的成分。右图是某品牌矿泉水中标签上的部分内容,则这瓶矿泉水中含Ca2+的物质的量≥ ▲ mol。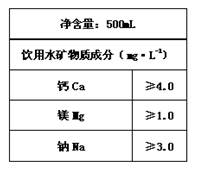
(2)现代生活离不开铝,工业上以铝土矿为原料生产铝。
现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500 mL溶液。取
100 mL该溶液,测得其中含有H+、Cl-、Mg2+、Al3+、Fe3+五种离子(不考虑其它离子)。
已知部分离子的物质的量浓度为:
c(H+) =" 0.02" mol·L-1 c(Mg2+) = 0.01 mol·L-1
c(Fe3+)=" 0.02" mol·L-1 c(Cl-) =" 0.52" mol·L-1
①溶液中Al3+物质的量浓度为 ▲ mol·L-1k*s5*u
②则该铝土矿样品中Al2O3的质量为 ▲ g(精确至0.01 g)。
科目:gzhx 来源: 题型:
①取440 mL甲溶液与120 mL乙溶液反应,产生1.56 g沉淀;
②取120 mL甲溶液与440 mL乙溶液反应,产生1.56 g沉淀;
③ 取120 mL甲溶液与400 mL乙溶液反应,产生3.12 g沉淀。
通过必要的计算和推理判定:
(1)甲溶液为____________溶液,其物质的量浓度为____________mol·L-1。乙溶液为____________溶液,其物质的量浓度为____________mol·L-1。
(2)写出实验③的有关离子方程式:________________________________________。
科目:gzhx 来源:2012-2013学年天津市武清区杨村一中高一第一次月考化学试卷(带解析) 题型:填空题
(15分)(1)3.01×1022个OH¯的物质的量为 ;这些OH¯与 molNH3的质量相等,与 g Na+含有的离子数相同。
(2)在标准状况下,2.24LNOx气体的质量为4.6g,则x的值为 。
(3)有四种正盐的混合溶液,含有0.2 mol·L-1 Na+、0.25 mol·L-1 Mg2+、0.4mol·L-1
Cl-,则SO 的浓度为
的浓度为
(4)、用14.2g硫酸钠配制成500mL溶液,其物质的量浓度为 mol/L。若从中取出50mL,其物质的量浓度为 mol/L,溶液中含Na+的个数为
若将这50mL溶液用水稀释到100mL, SO42-的物质的量浓度为 mol/L。
科目:gzhx 来源:2013-2014学年福建省泉州市高三质检理综化学试卷(解析版) 题型:填空题
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
A.高空排放
B.用纯碱溶液吸收制备亚硫酸钠
C.用氨水吸收后,再经氧化制备硫酸铵
D.用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2 ,Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有_____。
A过滤;B加过量NaOH溶液;C蒸发结晶;D灼烧;E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
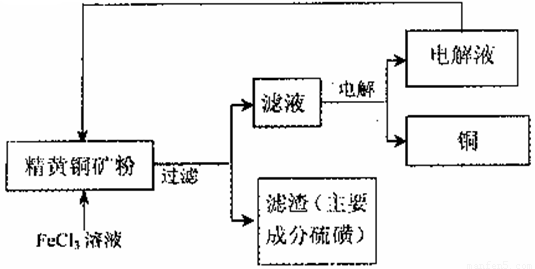
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为 _____________。
(5)该工艺流程中,可以循环利用的物质是_____(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
科目:gzhx 来源:2012-2013学年黑龙江省高三第三次阶段化学试卷(解析版) 题型:选择题
将一定质量的镁.铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.标况下产物NO的体积为22.4升
科目:gzhx 来源:2011-2012年湖南湘潭等四县一中高一下学期期中联考化学试卷(解析版) 题型:实验题
某研究性学习小组设计了如下二组实验:
(I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。
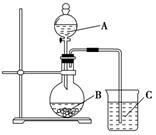
设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:
A: ,B: ,C: 。
(2)写出烧杯中发生反应的离子方程式: 。
(Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3 溶液改成物质的量浓度为 mol/L 的Fe2(SO4)3溶液。
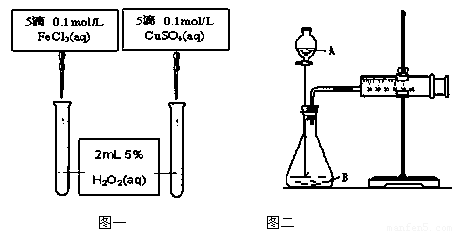
(2)检查图二装置气密性的方法是 ;
图二所示实验中需测量的数据是 。
科目:gzhx 来源:2015届浙江省等三校高一上学期期末联考化学试卷(解析版) 题型:计算题
(6分)下表是某“加碘食盐”包装袋上的部分文字说明。
|
配料 |
氯化钠(NaCl)、碘酸钾(KIO3) |
|
含碘量 |
20~40 mg·kg-1 |
|
保质期 |
18个月 |
|
食用方法 |
勿长时间炖炒 |
|
贮藏指南 |
避热、避光、密封、防潮 |
(1)经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计箅每千克“加碘食盐”中KIO3的物质的量为 mol,该“加碘食盐”的含碘量为 mg·kg-1。
(2)将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO离子物质的量浓度为
mol·L-1。
科目:gzhx 来源: 题型:
(1)矿泉水中往往含多种有益于人体健康的成分。右图是某品牌矿泉水中标签上的部分内容,则这瓶矿泉水中含Ca2+的物质的量≥ ▲ mol。
(2)现代生活离不开铝,工业上以铝土矿为原料生产铝。
现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500 mL溶液。取
100 mL该溶液,测得其中含有H+、Cl-、Mg2+、Al3+、Fe3+五种离子(不考虑其它离子)。
已知部分离子的物质的量浓度为:
c(H+) = 0.02 mol·L-1 c(Mg2+) = 0.01 mol·L-1
c(Fe3+)= 0.02 mol·L-1 c(Cl-) = 0.52 mol·L-1
①溶液中Al3+物质的量浓度为 ▲ mol·L-1k*s5*u
②则该铝土矿样品中Al2O3的质量为 ▲ g(精确至0.01 g)。
科目:gzhx 来源:2011-2012学年浙江省东阳市南马高中高三下学期期中考试化学试卷 题型:填空题
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
科目:gzhx 来源: 题型:
(6分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及其物质的量浓度,进行以下实验:
①量取25.00ml甲溶液,向其中缓慢滴入乙溶液15.00ml,共收集到224ml(标准状况)气体。②量取15.00ml乙溶液,向其中缓慢滴入甲溶液25.00ml,共收集到112ml(标准状况)气体。
⑴判断:甲是 溶液,其物质的量浓度为 mol/L。
乙是 溶液,其物质的量浓度为 mol/L。
⑵实验②中所发生反应的离子方程式为 。
科目:gzhx 来源:2011-2012学年内蒙古巴彦淖尔市中学高三期中考试化学试卷 题型:填空题
(6分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及其物质的量浓度,进行以下实验:
①量取25.00ml甲溶液,向其中缓慢滴入乙溶液15.00ml,共收集到224ml(标准状况)气体。②量取15.00ml乙溶液,向其中缓慢滴入甲溶液25.00ml,共收集到112ml(标准状况)气体。
⑴判断:甲是 溶液,其物质的量浓度为 mol/L。
乙是 溶液,其物质的量浓度为 mol/L。
⑵实验②中所发生反应的离子方程式为 。
科目:gzhx 来源:2012届浙江省东阳市高三下学期期中考试化学试卷 题型:填空题
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。