
科目:gzhx 来源: 题型:阅读理解
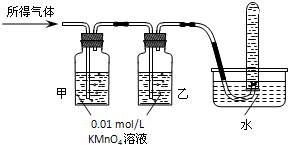 工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 溶液紫红色褪去 |
含有Fe2+ 含有Fe2+ |
| 步骤②: 另取少量所得溶液,滴加KI和淀粉溶液 另取少量所得溶液,滴加KI和淀粉溶液 |
溶液变为蓝色 溶液变为蓝色 |
含有Fe3+ | |
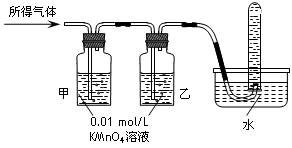
| 验证猜想Ⅱ | 将所得气体通入如下装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变;试管中收集到气体 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变;试管中收集到气体 |
含有两种或以上气体 |
科目:gzhx 来源: 题型:
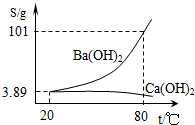 如图为Ba(OH)2和Ca(OH)2的溶解度曲线,现有一份氢氧化钙和氢氧化钡混合溶液样品.关于该混合溶液说法错误的是( )
如图为Ba(OH)2和Ca(OH)2的溶解度曲线,现有一份氢氧化钙和氢氧化钡混合溶液样品.关于该混合溶液说法错误的是( )| A、其他条件不变,将80℃的混合液降温至20℃,其溶液中所含的Ca(OH)2的物质的量不会发生改变 | B、其他条件不变,将80℃的混合液降温至20℃,此时溶液中Ba(OH)2和Ca(OH)2的浓度相同 | C、若混合液是大量Ba(OH)2和少量Ca(OH)2组成,可以先制得80℃的浓溶液,降温结晶过滤后可获得较纯净的Ba(OH)2晶体 | D、若混合液是大量Ca(OH)2和少量Ba(OH)2组成,可以在80℃蒸发溶剂,蒸发至晶体析出后,趁热过滤获得较纯的Ca(OH)2晶体 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
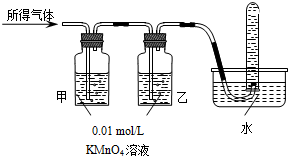 (2010•揭阳模拟)铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.1mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
(2010•揭阳模拟)铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.1mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液 | 溶液紫红色褪去 溶液紫红色褪去 |
含有Fe2+ 含有Fe2+ |
| 步骤②: 另取少量所得溶液,滴加KI溶液和淀粉溶液 另取少量所得溶液,滴加KI溶液和淀粉溶液 |
溶液变为蓝色 溶液变为蓝色 |
含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 |
含有两种气体 |
科目:gzhx 来源: 题型:
科目:gzhx 来源:09-10年梅县东山中学高一下学期期末考试化学卷 题型:实验题
(16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
【实验探究】
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种气体 |

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
。
科目:gzhx 来源:2013届陕西省渭南市高二上学期期中考试化学试卷 题型:选择题
在容积不变的密闭容器中,一定条件下发生反应:2A  B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是
( )
B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是
( )
A 升高温度,正反应速率增大,逆反应速率减小
B 若正反应是放热反应,则A为气态
C 物质A一定为非气态,且正反应是吸热反应
D 若向容器中充入惰性气体,则平衡向右移动
科目:gzhx 来源:2012-2013学年辽宁瓦房店高级中学高二上学期期中考试化学试卷(带解析) 题型:单选题
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.平衡体系中加入少量C,平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
科目:gzhx 来源:2010—2011学年福建省安溪一中、养正中学高二下学期期末联考化学试卷(理) 题型:填空题
(13分)
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 molσ键和 molπ键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
科目:gzhx 来源:2013-2014学年安徽省三校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3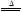 2KNO2+O2↑
2KNO2+O2↑
II.2Cu(NO3)
2 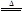 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
III.2AgNO3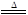 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为 。
②若该固体是混合物,则该混合物的可能组成为 。
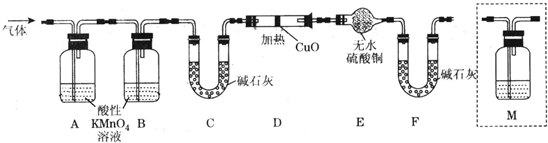
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
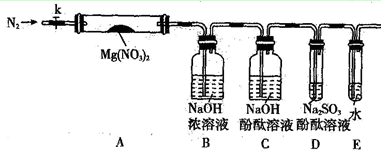
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g 。
①步骤a的目的是 ;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为: 。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为 ,用离子方程式表示出现该现象的原因:_____________________ 。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进? 。
科目:gzhx 来源: 题型:阅读理解
(化学-物质结构与性质)
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),
其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。

A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
(6)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
若有1mol CH4生成,则有 molσ键和 molπ键断裂。
科目:gzhx 来源: 题型:
(16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
【实验探究】
|
| 实验操作 | 预期现象 | 结 论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
|
|
| 步骤②: |
| 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 |
| 含有两种气体 |
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
。
科目:gzhx 来源:2013届福建省漳州立人学校高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 mol σ键和 mol π键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)。
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
科目:gzhx 来源:2013-2014学年浙江省高三上学期第二次月考化学试卷(解析版) 题型:实验题
工业上常用铁质容器盛装冷浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.10 mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有 气体。
【实验探究】
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液中 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种或以上气体 |
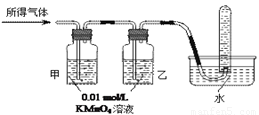
【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行,并说明原因: 。
(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如下图(图中夹持仪器省略)。
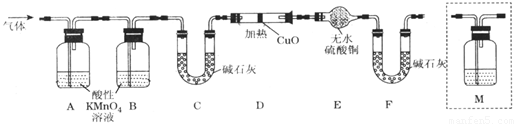
①Q产生的原因是 (用化学方程式表示)。
②为确认Q的存在,则M中盛放的试剂为 ,并将装置M添加于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图中D、E、F组合的作用是 。
科目:gzhx 来源:09—10年梅县东山中学高一下学期期末考试化学卷 题型:实验题
(16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
【实验探究】
| | 实验操作 | 预期现象 | 结 论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 | | |
| 步骤②: | | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | | 含有两种气体 |
科目:gzhx 来源:2011-2012学年山东省淄博市高三上学期期中模块考试化学试卷 题型:选择题
在容积不变的密闭容器中,一定条件下发生反应:2A B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入稀有气体,则平衡向右移动