精英家教网 >
试题搜索列表 >某化学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究
某化学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究答案解析
科目:czhx
来源:
题型:
(2009•西宁)某兴趣小组探究酸碱中和反应,小明在盛有氢氧化钠溶液的试管中,滴加酚酞后,又滴加了稀盐酸,震荡后得到A溶液呈无色,他认为盐酸和氢氧化钠溶液恰好完全中和,
(1)写出该中和反应的化学方程式
NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.
(2)小红认为小明的结论不对.小红的观点是A溶液呈无色有两种可能,一种可能是
盐酸和氢氧化钠溶液恰好完全反应
盐酸和氢氧化钠溶液恰好完全反应
,另一种可能是
盐酸过量
盐酸过量
.
(3)请你设计一个实验,帮助他们确定A溶液中,酸、碱是否完全中和.填写实验报告.
| 实验步骤 |
实验现象及结论 |
取适量的反应后的溶液于试管中,然后向试管中加入锌粒, 取适量的反应后的溶液于试管中,然后向试管中加入锌粒, |
产生气泡,说明盐酸过量 产生气泡,说明盐酸过量 |
查看答案和解析>>
科目:czhx
来源:西宁
题型:问答题
某兴趣小组探究酸碱中和反应,小明在盛有氢氧化钠溶液的试管中,滴加酚酞后,又滴加了稀盐酸,震荡后得到A溶液呈无色,他认为盐酸和氢氧化钠溶液恰好完全中和,
(1)写出该中和反应的化学方程式______.
(2)小红认为小明的结论不对.小红的观点是A溶液呈无色有两种可能,一种可能是______,另一种可能是______.
(3)请你设计一个实验,帮助他们确定A溶液中,酸、碱是否完全中和.填写实验报告.
| 实验步骤 |
实验现象及结论 |
| ______ |
______ |
查看答案和解析>>
科目:czhx
来源:2009年青海省西宁市中考化学试卷(解析版)
题型:解答题
某兴趣小组探究酸碱中和反应,小明在盛有氢氧化钠溶液的试管中,滴加酚酞后,又滴加了稀盐酸,震荡后得到A溶液呈无色,他认为盐酸和氢氧化钠溶液恰好完全中和,
(1)写出该中和反应的化学方程式______.
(2)小红认为小明的结论不对.小红的观点是A溶液呈无色有两种可能,一种可能是______,另一种可能是______.
(3)请你设计一个实验,帮助他们确定A溶液中,酸、碱是否完全中和.填写实验报告.
查看答案和解析>>
科目:czhx
来源:
题型:解答题
某兴趣小组探究酸碱中和反应,小明在盛有氢氧化钠溶液的试管中,滴加酚酞后,又滴加了稀盐酸,震荡后得到A溶液呈无色,他认为盐酸和氢氧化钠溶液恰好完全中和,
(1)写出该中和反应的化学方程式______.
(2)小红认为小明的结论不对.小红的观点是A溶液呈无色有两种可能,一种可能是______,另一种可能是______.
(3)请你设计一个实验,帮助他们确定A溶液中,酸、碱是否完全中和.填写实验报告.
查看答案和解析>>
科目:czhx
来源:
题型:
书写下列化学方程式,并在括号内注明基本反应类型
(1)铁丝在氧气中燃烧
;
化合反应
化合反应
(2)镁在空气中燃烧
;
化合反应
化合反应
(3)锌和稀硫酸
Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
;
置换反应
置换反应
(4)铁和稀硫酸反应
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
;
置换反应
置换反应
(5)铜丝放入硝酸银溶液中
Cu+2AgNO3=Cu(NO3)2+2Ag
Cu+2AgNO3=Cu(NO3)2+2Ag
;
置换反应
置换反应
(6)稀硫酸与氯化钡
H2SO4+BaCl2=2HCl+BaSO4↓
H2SO4+BaCl2=2HCl+BaSO4↓
;
复分解反应
复分解反应
(7)稀盐酸与氢氧化钠溶液混合
NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
;
复分解反应
复分解反应
(8)稀盐酸与硝酸银
HCl+AgNO3=HNO3+AgCl↓
HCl+AgNO3=HNO3+AgCl↓
.
复分解反应
复分解反应
.
查看答案和解析>>
科目:czhx
来源:
题型:
化学兴趣小组的同学用实验室久置的氢氧化钠固体配置成溶液后,做酸碱中和反应实验,将稀盐酸滴入溶液中,观察到有气泡产生,同学们推测可能是氢氧化钠固体久置发生了变质.
分析:氢氧化钠变质的原因是(用化学方程式表示)
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
.
提出问题:该氢氧化钠固体是全部变质还是部分变质?
查阅资料:氯化钙溶液和氯化钠溶液均呈中性
设计实验:依据查阅的资料设计实验如下表所示
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量固体于试管中,加水配置成溶液,往其中滴加过量氯化钙溶液,并不断振荡. |
有 白色沉淀 白色沉淀 生成 |
说明原固体中一定含有碳酸钠.
反应的化学方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl CaCl2+Na2CO3═CaCO3↓+2NaCl |
| (2)取(1)试管中的上层清液滴加酚酞试液. |
溶液变红色 |
说明原固体中一定含有 氢氧化钠 氢氧化钠 . |
实验结论:该兴趣小组的同学得出的结论是:氢氧化钠固体
部分变质
部分变质
(填“部分变质”或“全部变质”).
定量实验:探究氢氧化钠固体的变质程度

请计算,该氢氧化钠固体的变质程度是
59.7%
59.7%
(精确到0.1%)
查看答案和解析>>
科目:czhx
来源:
题型:阅读理解
(2009•永州)某中学化学兴趣小组学习复分解反应后,在老师的指导下,对海水晒制得到的粗盐进行研究性学习.
【提出问题】如何将粗盐加以提纯成为精盐(NaCl)?
【查阅资料】
资料一:粗盐中主要成分是NaCl,其中还含有MgCl
2、CaCl
2、MgSO
4以及泥沙等杂质.
资料二:20℃,一些物质的溶解性如下表
| 可溶 |
MgCl2、CaCl2、Ba(NO3)2、Na2CO3、Na2SO4、Ba(OH)2、BaCl2 |
| 不溶 |
CaCO3、Mg(OH)2、BaSO4、BaCO3 |
【设计实验】下列为粗盐提纯的实验操作,请你帮助填写好表中的两个空格.
| 实验步骤一 |
实验涉及的化学反应方程式 |
实验目的 |
| ①将粗盐完全溶于水 |
|
泥沙等不溶杂质沉淀 |
| ②加入稍过量的BaCl2溶液 |
MgSO4+BaCl2═BaSO4↓+MgCl2 |
除去其中sO42-离子 |
| ③加入稍过量的NaOH溶液 |
MgCl2+2NaOH═Mg(OH)2↓+2NaCl MgCl2+2NaOH═Mg(OH)2↓+2NaCl |
除去其中Mg2+离子 |
| ④加入稍过量的Na2CO3溶液 |
CaCl2+Na2CO3═CaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl |
除去Ca2+和Ba2+离子 |
| ⑤进行 过滤 过滤 操作 |
|
将沉淀物与液体分开 |
| ⑥滤液中加入适量的盐酸 |
Na2CO3+2HCl═2NaCl+CO2+H2O
NaOH+HCl═NaCl+H2O |
除去过量的CO32-和OH-离子 |
| ⑦将滤液蒸发、结晶、烘干 |
|
得到精盐(NaCl) |
【分析讨论】
(1)甲同学认为上述实验步骤②中的BaCl
2溶液不可改用Ba(NO
3)
2溶液,其理由是
加入Ba(NO3)2溶液,会引入NO3-杂质离子
加入Ba(NO3)2溶液,会引入NO3-杂质离子
.
(2)乙同学提出加入一种试剂将上述实验步骤②、③合二为一,可以达到同样的实验效果,你认为这种试剂应选用
Ba(OH)2
Ba(OH)2
(写化学式).
(3)丙同学分析得出,在上述实验中可将实验步骤②和
③
③
(填实验步骤序号)交换顺序,也不会影响实验效果.
查看答案和解析>>
科目:czhx
来源:
题型:
某校学习小组测定酸碱中和反应.他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液pH=7.请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:
题型:阅读理解
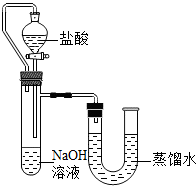
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
(1)配制100g质量分数为8%的氢氧化钠溶液.
①计算:需要氢氧化钠固体的质量为
g,水的体积为
mL(水的密度近似看作1g/cm
3).
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的
盘,称量其质量.然后按需要添加砝码、移动游码,再将氢氧化钠固体加入烧杯中,直至天平平衡.该步骤中用烧杯而不用纸称量氢氧化钠的原因是
.
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温.
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签.
(2)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
【实验方案】
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且最终小至小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
①用pH试纸测定NaOH溶液pH时,正确的操作是:
.
②简述强调“测得的pH小于7”的理由:
.
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.该组同学在没使用温度计的情况下,通过如图所示装置完成了实验.则该组同学根据
.
查看答案和解析>>
科目:czhx
来源:
题型:
某校学习小组测定酸碱中和反应。他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液PH=7。请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:2011-2012学年安徽省毕业学业考试化学模拟试题1
题型:计算题
某校学习小组测定酸碱中和反应。他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液PH=7。请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:2012届安徽省初中毕业学业考试化学模拟试题1
题型:计算题
某校学习小组测定酸碱中和反应。他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液PH=7。请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:
题型:
某校学习小组测定酸碱中和反应。他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液PH=7。请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:
题型:解答题
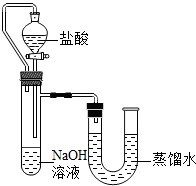 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
(1)配制100g质量分数为8%的氢氧化钠溶液.
①计算:需要氢氧化钠固体的质量为______g,水的体积为______mL(水的密度近似看作1g/cm3).
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的______盘,称量其质量.然后按需要添加砝码、移动游码,再将氢氧化钠固体加入烧杯中,直至天平平衡.该步骤中用烧杯而不用纸称量氢氧化钠的原因是______.
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温.
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签.
(2)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
【实验方案】
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且最终小至小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
①用pH试纸测定NaOH溶液pH时,正确的操作是:______.
②简述强调“测得的pH小于7”的理由:______.
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.该组同学在没使用温度计的情况下,通过如图所示装置完成了实验.则该组同学根据______.
查看答案和解析>>
科目:czhx
来源:2009年湖南省永州市中考化学试卷(解析版)
题型:解答题
某中学化学兴趣小组学习复分解反应后,在老师的指导下,对海水晒制得到的粗盐进行研究性学习.
【提出问题】如何将粗盐加以提纯成为精盐(NaCl)?
【查阅资料】
资料一:粗盐中主要成分是NaCl,其中还含有MgCl
2、CaCl
2、MgSO
4以及泥沙等杂质.
资料二:20℃,一些物质的溶解性如下表
| 可溶 | MgCl2、CaCl2、Ba(NO3)2、Na2CO3、Na2SO4、Ba(OH)2、BaCl2 |
| 不溶 | CaCO3、Mg(OH)2、BaSO4、BaCO3 |
【设计实验】下列为粗盐提纯的实验操作,请你帮助填写好表中的两个空格.
| 实验步骤一 | 实验涉及的化学反应方程式 | 实验目的 |
| ①将粗盐完全溶于水 | | 泥沙等不溶杂质沉淀 |
| ②加入稍过量的BaCl2溶液 | MgSO4+BaCl2═BaSO4↓+MgCl2 | 除去其中sO42-离子 |
| ③加入稍过量的NaOH溶液 | ______ | 除去其中Mg2+离子 |
| ④加入稍过量的Na2CO3溶液 | CaCl2+Na2CO3═CaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl | 除去Ca2+和Ba2+离子 |
| ⑤进行______操作 | | 将沉淀物与液体分开 |
| ⑥滤液中加入适量的盐酸 | Na2CO3+2HCl═2NaCl+CO2+H2O
NaOH+HCl═NaCl+H2O | 除去过量的CO32-和OH-离子 |
| ⑦将滤液蒸发、结晶、烘干 | | 得到精盐(NaCl) |
【分析讨论】
(1)甲同学认为上述实验步骤②中的BaCl
2溶液不可改用Ba(NO
3)
2溶液,其理由是______.
(2)乙同学提出加入一种试剂将上述实验步骤②、③合二为一,可以达到同样的实验效果,你认为这种试剂应选用______(写化学式).
(3)丙同学分析得出,在上述实验中可将实验步骤②和______ (填实验步骤序号)交换顺序,也不会影响实验效果.
查看答案和解析>>
科目:czhx
来源:2012年湖南省怀化市芷江县杨公庙中学中考化学模拟试卷(解析版)
题型:解答题
某校学习小组测定酸碱中和反应.他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液pH=7.请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:2012年安徽省中考化学模拟试卷(一)(解析版)
题型:解答题
某校学习小组测定酸碱中和反应.他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液pH=7.请你帮他们计算:所用稀盐酸溶质的质量分数是多少?
查看答案和解析>>
科目:czhx
来源:
题型:解答题
某中学化学兴趣小组学习复分解反应后,在老师的指导下,对海水晒制得到的粗盐进行研究性学习.
【提出问题】如何将粗盐加以提纯成为精盐(NaCl)?
【查阅资料】
资料一:粗盐中主要成分是NaCl,其中还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质.
资料二:20℃,一些物质的溶解性如下表
| 可溶 | MgCl2、CaCl2、Ba(NO3)2、Na2CO3、Na2SO4、Ba(OH)2、BaCl2 |
| 不溶 | CaCO3、Mg(OH)2、BaSO4、BaCO3 |
【设计实验】下列为粗盐提纯的实验操作,请你帮助填写好表中的两个空格.
| 实验步骤一 | 实验涉及的化学反应方程式 | 实验目的 |
| ①将粗盐完全溶于水 | | 泥沙等不溶杂质沉淀 |
| ②加入稍过量的BaCl2溶液 | MgSO4+BaCl2═BaSO4↓+MgCl2 | 除去其中sO42-离子 |
| ③加入稍过量的NaOH溶液 | ______ | 除去其中Mg2+离子 |
| ④加入稍过量的Na2CO3溶液 | CaCl2+Na2CO3═CaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl | 除去Ca2+和Ba2+离子 |
| ⑤进行______操作 | | 将沉淀物与液体分开 |
| ⑥滤液中加入适量的盐酸 | Na2CO3+2HCl═2NaCl+CO2+H2O
NaOH+HCl═NaCl+H2O | 除去过量的CO32-和OH-离子 |
| ⑦将滤液蒸发、结晶、烘干 | | 得到精盐(NaCl) |
【分析讨论】
(1)甲同学认为上述实验步骤②中的BaCl
2溶液不可改用Ba(NO
3)
2溶液,其理由是______.
(2)乙同学提出加入一种试剂将上述实验步骤②、③合二为一,可以达到同样的实验效果,你认为这种试剂应选用______(写化学式).
(3)丙同学分析得出,在上述实验中可将实验步骤②和______ (填实验步骤序号)交换顺序,也不会影响实验效果.
查看答案和解析>>
科目:czhx
来源:
题型:
化学兴趣小组的同学用实验室久置的氢氧化钠固体配置成溶液后,做酸碱中和反应实验,将稀盐酸滴入溶液中,观察到有气泡产生,同学们推测可能是氢氧化钠固体久置发生了变质。
【分 析】 氢氧化钠变质的原因是(用化学方程式表示) 。
【提出问题】该氢氧化钠固体是全部变质还是部分变质?
【查阅资料】氯化钙溶液和氯化钠溶液均呈中性
【设计实验】依据查阅的资料设计实验如下表所示
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量固体于试管中,加水配置成溶液,往其中滴加过量氯化钙溶液,并不断振荡。 | 有________ 生成 | 说明原固体中一定含有碳酸钠。 反应的化学方程式是_____ __ __ |
| (2)取(1)试管中的上层清液滴加酚酞试液。 | 溶液变红色 | 说明原固体中一定含有 。 |
【实验结论】该兴趣小组的同学得出的结论是:氢氧化钠固体 (填“部分变质”
或“全部变质”)。
【定量实验】探究氢氧化钠固体的变质程度

请计算, 该氢氧化钠固体的变质程度是___________(精确到0.1%)
该氢氧化钠固体的变质程度是___________(精确到0.1%)
查看答案和解析>>
科目:czhx
来源:永州
题型:问答题
某中学化学兴趣小组学习复分解反应后,在老师的指导下,对海水晒制得到的粗盐进行研究性学习.
【提出问题】如何将粗盐加以提纯成为精盐(NaCl)?
【查阅资料】
资料一:粗盐中主要成分是NaCl,其中还含有MgCl
2、CaCl
2、MgSO
4以及泥沙等杂质.
资料二:20℃,一些物质的溶解性如下表
| 可溶 |
MgCl2、CaCl2、Ba(NO3)2、Na2CO3、Na2SO4、Ba(OH)2、BaCl2 |
| 不溶 |
CaCO3、Mg(OH)2、BaSO4、BaCO3 |
【设计实验】下列为粗盐提纯的实验操作,请你帮助填写好表中的两个空格.
| 实验步骤一 |
实验涉及的化学反应方程式 |
实验目的 |
| ①将粗盐完全溶于水 |
|
泥沙等不溶杂质沉淀 |
| ②加入稍过量的BaCl2溶液 |
MgSO4+BaCl2═BaSO4↓+MgCl2 |
除去其中sO42-离子 |
| ③加入稍过量的NaOH溶液 |
______ |
除去其中Mg2+离子 |
| ④加入稍过量的Na2CO3溶液 |
CaCl2+Na2CO3═CaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl |
除去Ca2+和Ba2+离子 |
| ⑤进行______操作 |
|
将沉淀物与液体分开 |
| ⑥滤液中加入适量的盐酸 |
Na2CO3+2HCl═2NaCl+CO2+H2O
NaOH+HCl═NaCl+H2O |
除去过量的CO32-和OH-离子 |
| ⑦将滤液蒸发、结晶、烘干 |
|
得到精盐(NaCl) |
【分析讨论】
(1)甲同学认为上述实验步骤②中的BaCl
2溶液不可改用Ba(NO
3)
2溶液,其理由是______.
(2)乙同学提出加入一种试剂将上述实验步骤②、③合二为一,可以达到同样的实验效果,你认为这种试剂应选用______(写化学式).
(3)丙同学分析得出,在上述实验中可将实验步骤②和______ (填实验步骤序号)交换顺序,也不会影响实验效果.
查看答案和解析>>


 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
 该氢氧化钠固体的变质程度是___________(精确到0.1%)
该氢氧化钠固体的变质程度是___________(精确到0.1%)