
科目:czhx 来源: 题型:
某研究性学习小组,为了测定纯碱(假定只含氯化钠杂质)中碳酸钠的质量分数,称取纯碱固体11.2g,将其加入到50g稀盐酸中,恰好完全反应,使气体全部放出,得到氯化钠溶液56.8g。
请你计算:
(1)反应中产生![]() 的质量。
的质量。
(2)纯碱中碳酸钠的质量分数。
科目:czhx 来源: 题型:阅读理解
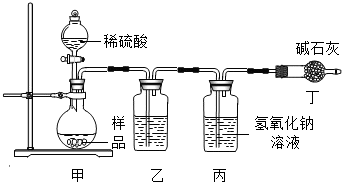 (2013•潍坊)某研究性学习小组设计了测定纯碱样品(含NaCl杂质)中碳酸钠质量分数的实验方案.请回答下列问题:
(2013•潍坊)某研究性学习小组设计了测定纯碱样品(含NaCl杂质)中碳酸钠质量分数的实验方案.请回答下列问题:| 106m |
| 197w |
| 106m |
| 197w |
科目:czhx 来源:2013年初中毕业升学考试(山东潍坊卷)化学(解析版) 题型:填空题
某研究性学习小组设计了测定纯碱样品(含NaCl杂质)中碳酸钠质量分数的实验方案。请回答下列问题:
(1)碳酸根离子沉淀法。实验步骤:
①用托盘天平称取wg样品放入烧杯中加水溶解;
②加入足量的BaCl2溶液成分反应,证明反应后剩余的方法是_______________________________________;
③过滤、洗涤、称量沉淀的质量为mg;④样品中碳酸钠的质量分数为_______________________。
(2)气体法。学习小组利用右图装置测定样品中碳酸钠的质量分数。
①实验装置乙中盛放的试剂为______________,装置丁的作用是______________________________________
______________________。
②学习小组通过测量丙装置实验前后的质量,确定二氧化碳的质量。实验中滴加稀硫酸的速度过快,产生的气流过急,会导致测得样品中碳酸钠的质量分数______________(填写“偏高”、“偏低”或“不变”)。
(3)测氯化钠法。请你完成下列实验方案:称取一定质量的样品放入烧杯中加水溶解;____________________
________________________________________________________________________________________;过滤、洗涤、干燥称量沉淀的质量。计算出氯化钠的质量,再得样品中碳酸钠的质量分数。
科目:czhx 来源:2013年山东省潍坊市中考化学试卷(解析版) 题型:填空题

科目:czhx 来源: 题型:阅读理解
| ||
| 106 |
| 100 |
| x |
| 10.00g |
| 10.6g |
| 13.25g |
| 106 |
| 100 |
| x |
| 10.00g |
| 10.6g |
| 13.25g |
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
| 53b |
| 22a |
科目:czhx 来源:2011-2012学年江苏省镇江市扬中市八年级(下)期中化学试卷(4月份)(解析版) 题型:解答题
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
科目:czhx 来源:2012年江苏省镇江市扬中市中考化学模拟试卷(4月份)(解析版) 题型:解答题
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
科目:czhx 来源:2011-2012学年江苏省镇江市扬中市八年级(下)期中化学试卷(解析版) 题型:解答题
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
科目:czhx 来源: 题型:
| 时间/分钟 | t1 | t2 | t3 | t4 | t5 |
| 体积/L | 1.52 | 2.54 | 3.05 | 3.35 | 3.35 |
科目:czhx 来源: 题型:解答题
| 时间/分钟 | t1 | t2 | t3 | t4 | t5 |
| 体积/L | 1.52 | 2.54 | 3.05 | 3.35 | 3.35 |
科目:czhx 来源:西城区二模 题型:问答题
| 时间/分钟 | t1 | t2 | t3 | t4 | t5 |
| 体积/L | 1.52 | 2.54 | 3.05 | 3.35 | 3.35 |
科目:czhx 来源: 题型:
科目:czhx 来源: 题型:
科目:czhx 来源: 题型:阅读理解
科目:czhx 来源:2011年山东省聊城市业水平考试化学试卷 题型:计算题
(6分)用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12g,加入到足量的氯化钡溶液中,恰好完全反应。过滤干燥后,称得沉淀质量为19.7g。请你帮助计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
科目:czhx 来源:2011年山东省聊城市初中学业水平考试化学试卷 题型:计算题
(6分)用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12g,加入到足量的氯化钡溶液中,恰好完全反应。过滤干燥后,称得沉淀质量为19.7g。请你帮助计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
科目:czhx 来源: 题型:
科目:czhx 来源: 题型:
(6分)用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12g,加入到足量的氯化钡溶液中,恰好完全反应。过滤干燥后,称得沉淀质量为19.7g。请你帮助计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
科目:czhx 来源:2011年山东省聊城市中考化学试卷(解析版) 题型:解答题
科目:czhx 来源:2006年第十六届“天原杯”全国初中学生化学素质和实验能力竞赛(广东赛区)初赛试卷(解析版) 题型:解答题