
科目:gzhx 来源:内蒙古包头三十三中2010-2011学年高一上学期期中考试Ⅰ化学试题 题型:013
|
10 g 20%的NaOH溶液与100 ml 20%的NaOH溶液的浓度相比较 | |
| [ ] | |
A. |
前者大 |
B. |
后者大 |
C. |
相同 |
D. |
无法比较 |
科目:gzhx 来源: 题型:
科目:gzhx 来源:广东省2009届高三化学各地名校月考试题汇编-物质的量 题型:021
|
下列说法正确的是 | |
A. |
把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度改变为1.5 mol·L-1 |
B. |
把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
C. |
把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的C(Cl-)仍然是3 mol·L-1 |
D. |
把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% |
科目:gzhx 来源:湖南省长沙市一中2010-2011学年高一上学期期末考试化学试题 题型:022
准确称取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如下图.

试回答下列问题:
(1)当加入NaOH溶液的体积超过35 mL时所发生的反应的离子方程式为________;
(2)硫酸溶液的物质的量浓度为________mol/L;
(3)若b=2.3,则铝土矿中SiO2的质量百分含量是________?
(4)a值的范围在之间,在这个范围内,a值越大,________含量越少.
科目:gzhx 来源:不详 题型:填空题
科目:gzhx 来源:同步题 题型:计算题

科目:gzhx 来源:江西省白鹭洲中学2011届高三第二次月考化学试题 题型:013
|
准确称取 6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100 mL硫酸溶液,充分反应后向滤液中加入10 mol/L的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则所用硫酸溶液的物质的量浓度为
| |
| [ ] | |
A. |
3.50 mol/L |
B. |
1.75 mol/L |
C. |
0.85 mol/L |
D. |
无法计算 |
科目:gzhx 来源:龙之脉新教材完全解读 高中化学 必修1 配鲁科版 鲁科版 题型:022
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:

请填空回答:
(1)H2SO4溶液的物质的量浓度为________.
(2)若a=2.3,用于沉淀Fe3+,消耗NaOH的体积是________mL,铝土矿中各组成成分的质量分数:Al2O3为________,Fe2O3为________,SiO2为________.
(3)a值的范围应是________,在这个范围内,a值越大________的质量分数越小.
科目:gzhx 来源:吉林省白山二中2012届高三第二次月考化学试题 题型:022
将40 g NaOH溶于水,配成250 mL溶液甲,甲的浓度为________mol/L
(将正确选项的标号填入空格,下同).将50 mL甲加水稀释至100 mL后,得溶液乙,乙的浓度为________mol/L.将10 mL乙溶液与质量分数为9%、密度为1.11 g/cm3的NaOH溶液10 mL混合,该混合溶液丙的浓度为________mol/L(忽略溶液体积变化).混合溶液丙能与________mL 0.5 mol/L的盐酸恰好完全中和.
科目:gzhx 来源:2012-2013学年黑龙江省大庆实验中学高二(上)期末化学试卷(解析版) 题型:填空题
科目:gzhx 来源:同步题 题型:单选题
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
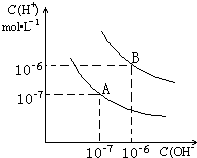 已知水在25℃和99℃时,其电离平衡曲线如图所示:
已知水在25℃和99℃时,其电离平衡曲线如图所示:科目:gzhx 来源: 题型:
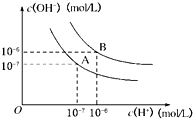 (2006•成都模拟)水的电离平衡曲线如图所示:
(2006•成都模拟)水的电离平衡曲线如图所示:科目:gzhx 来源: 题型:
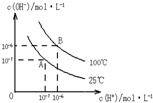 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: