
科目:gzhx 来源: 题型:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
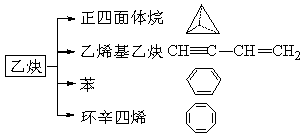
完成下列各题:
(1)正四面体烷的分子式为 ,其二氯取代产物有 种。
(2)关于乙烯基乙炔分子的说法错误的是:
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子所有原子肯定共面
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量乙炔多
(3)写出与环辛四烯互为同分异构体且属于芳香烃分子的结构简式: 。
(4)写出分子式为C8H10苯的同系物中一氯代物有三种的物质的结构简式: 。
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
A.0.012 kg碳
B.含有6.02×1023个粒子的物质
C.含有阿伏加德罗常数个粒子的物质
D.含有与6.02×1023个碳原子等质量的物质
科目:gzhx 来源: 题型:
1 mol物质的含义是()
A.0.012 kg碳
B.含有6.02×10![]() 个粒子的物质
个粒子的物质
C.含有阿伏加德罗常数个粒子的物质
D.含有与6.02×10![]() 个碳原子等质量的物质
个碳原子等质量的物质
科目:gzhx 来源:2014届湖北省高二第一次月考化学试卷(解析版) 题型:填空题
(11分)能源可划分为一次能源和二次能源。自然界中以现成形式提供的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。氢气是一种高效而没有污染的二次能源,它可以由自然界中大量存在的水来制取:2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ/mol。根据以上叙述回答:
(1)下列叙述正确的是 。(不定项选择)(4分)
A.电能是二次能源 B.水力是二次能源
C.天然气是一次能源 D.焦炉气是一次能源
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol,等质量的氢气和甲烷分别完全燃烧后,放出的热量之比约为( )(3分)
A.1∶3.4 B.1∶1.7 C.2.6∶1 D.4.6∶1
(3)关于用水制取二次能源氢气,以下研究方向不正确的是 。(不定项选择)(4分)
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
科目:gzhx 来源: 题型:
(1)我们知道,稀盐酸与铜不反应。但在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为________________________。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜溶于稀盐酸。请在下列方框中画出该装置图。

(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol。则该硫酸的实际体积____________(填“大于”“等于”或“小于”)100 mL。若欲使剩余的铜片继续溶解,可在其中加入硝酸盐,该反应的离子方程式为______________________。
(3)将两份等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度不同引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是____________________________________。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)____________________________________。
科目:gzhx 来源:2013届河北省高二第一次考试理科化学试卷(解析版) 题型:选择题
已知反应:①Al+Fe2O3 Al2O3+Fe △H=a kJ/mol
Al2O3+Fe △H=a kJ/mol
②101kPa时,2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol
③稀溶液中,H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ/mol
④红磷的化学式为P,白磷的化学式为P4,已知:P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol 4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol 下列结论正确的是
A.铝热反应在高温下才能发生,因此a>0
B.碳的燃烧热等于110.5 kJ/mol
C.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ
D.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低
科目:gzhx 来源:2013届湖北省洪湖市四校高二下学期期中联合考试化学试卷(解析版) 题型:填空题
(12分)乙炔是最简单的炔烃,实验室可以用电石(主要成分CaC 2)与水反应制备乙炔。乙炔是一种重要的有机化工原料,在催化剂存在的条件下,加热至150℃~160℃,乙炔与氯化氢发生反应,生成重要的化工原料氯乙烯。以乙炔为原料在不同的反应条件下还可以转化成以下化合物。

完成下列各题:
(1)写出实验室制备乙炔的化学方程式_____________________________________
(2)写出制备氯乙烯的化学方程式______________________________________。
(3)乙炔中C原子的杂化方式是____________________。
(4)正四面体烷的核磁共振氢谱图中有___________个峰。
(5)关于乙烯基乙炔分子的说法正确的是:________________
a 、乙烯基乙炔不能使溴的四氯化碳溶液褪色
b 、乙烯基乙炔分子内只含有一种官能团
c 、1mol乙烯基乙炔最多能与3molH2发生加成反应
d 、等物质的量的乙炔与乙烯基乙炔完全燃烧时的耗氧量为1:2
e 、等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同
f 、乙烯基乙炔与正四面体烷互为同分异构体
(6)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:_________
科目:gzhx 来源: 题型:
已知反应:
①101 kPa时,2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H +(aq)+OH-(aq) ====H2O(l) ΔH=-57.3 kJ·mol-1
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)====P4O10(s) ΔH=-3 093.2 kJ·mol-1
4P(s)+5O2(g)====P4O10(s) ΔH=-2 954.0 kJ·mol-1
下列结论正确的是
A.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低
B.碳的燃烧热大于221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的反应热ΔH=-57.3 kJ·mol-1
D.浓硫酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ
科目:gzhx 来源:2012-2013学年湖北省监利县柘木中学高二第一次月考化学试卷(带解析) 题型:填空题
(11分)能源可划分为一次能源和二次能源。自然界中以现成形式提供的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。氢气是一种高效而没有污染的二次能源,它可以由自然界中大量存在的水来制取:2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ/mol。根据以上叙述回答:
(1)下列叙述正确的是 。(不定项选择)(4分)
A.电能是二次能源 B.水力是二次能源
C.天然气是一次能源 D.焦炉气是一次能源
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol,等质量的氢气和甲烷分别完全燃烧后,放出的热量之比约为( )(3分)
A.1∶3.4 B.1∶1.7 C.2.6∶1 D.4.6∶1
(3)关于用水制取二次能源氢气,以下研究方向不正确的是 。(不定项选择)(4分)
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
科目:gzhx 来源: 题型:
(12分)乙炔是最简单的炔烃,实验室可以用电石(主要成分CaC 2)与水反应制备乙炔。乙炔是一种重要的有机化工原料,在催化剂存在的条件下,加热至150℃~160℃,乙炔与氯化氢发生反应,生成重要的化工原料氯乙烯。以乙炔为原料在不同的反应条件下还可以转化成以下化合物。
完成下列各题:
(1)写出实验室制备乙炔的化学方程式_____________________________________
(2)写出制备氯乙烯的化学方程式______________________________________。
(3)乙炔中C原子的杂化方式是____________________。
(4)正四面体烷的核磁共振氢谱图中有___________个峰。
(5)关于乙烯基乙炔分子的说法正确的是:________________
a 、乙烯基乙炔不能使溴的四氯化碳溶液褪色
b 、乙烯基乙炔分子内只含有一种官能团
c 、1mol乙烯基乙炔最多能与3molH2发生加成反应
d 、等物质的量的乙炔与乙烯基乙炔完全燃烧时的耗氧量为1:2
e 、等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同
f 、乙烯基乙炔与正四面体烷互为同分异构体
(6)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:_________
科目:gzhx 来源:2011-2012学年河北省正定中学高二第一次考试理科化学试卷(带解析) 题型:单选题
已知反应:①Al+Fe2O3 Al2O3+Fe △H=a kJ/mol
Al2O3+Fe △H=a kJ/mol
②101kPa时,2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol
③稀溶液中,H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ/mol
④红磷的化学式为P,白磷的化学式为P4,已知:P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol 4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol 下列结论正确的是
| A.铝热反应在高温下才能发生,因此a>0 |
| B.碳的燃烧热等于110.5 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ |
| D.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低 |
科目:gzhx 来源: 题型:单选题
已知反应:
①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H +(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
③红磷的化学式为P,白磷的化学式为P4,已知P4(s)+5O2(g)=P4O10(s) ΔH=-3 093.2 kJ·mol-14P(s)+5O2(g)=P4O10(s) ΔH=-2 954.0 kJ·mol-1
下列结论正确的是
科目:gzhx 来源: 题型:
科目:gzhx 来源:2012年人教版高中化学必修一1.2 化学计量在实验中的应用练习卷(解析版) 题型:选择题
1mol物质的含义是( )
A. 0.012kg碳
B. 含有6.02×1023个粒子的物质
C. 含有阿伏加德罗常数个粒子的物质
D. 含有与6.02×1023个碳原子等质量的物质
科目:gzhx 来源: 题型:
试推断:
A为_________、B为_________、C为________、D为_________、E为_________。(写名称)
科目:gzhx 来源:2010-2011学年湖北省天门市高三模拟考试(一)(理综)化学部分 题型:选择题
下列叙述中正确的是
A.向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2 CO3饱和溶液中通入CO2,有结晶析出
科目:gzhx 来源:2011-2012学年湖南省四市九校高三上学期第一次联考化学试卷 题型:填空题
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)
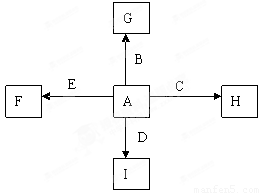
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键 (填“离子”或 “极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色
科目:gzhx 来源:2012届湖南省四市九校高三上学期第一次联考化学试卷 题型:填空题
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)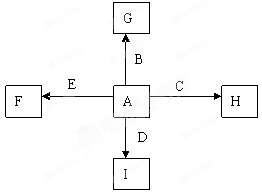
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红 褐色
褐色