
科目:gzhx 来源: 题型:
(08上海嘉定区期末)甲烷蒸气转化反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),工业上可利用
CO(g)+3H2(g),工业上可利用
此反应生产合成氨原料气H2。
已知温度、压强和水碳比[ ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:

图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
(1)该反应平衡常数K表达式为________________________。
(2)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);
升高温度,平衡向____________方向移动(选正反应或逆反应)。
(3)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
原因是____________________________________________________
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是?
科目:gzhx 来源:2012-2013学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:简答题
天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2 中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 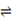 CO(g)
+ 3H2(g) ΔH = +206.2 kJ/mol
CO(g)
+ 3H2(g) ΔH = +206.2 kJ/mol
CH4(g) + 2H2O(g) 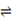 CO2(g)
+4H2(g) ΔH = +165.0kJ/mol
CO2(g)
+4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
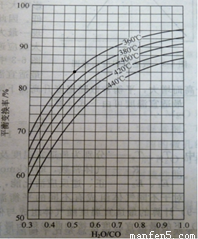
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是 。
② 汽气比相同时,CO平衡变换率与温度的关系是 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp= 。随温度的降低,该平衡常数 (填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
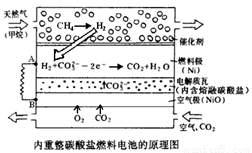
(1)外电路电子流动方向:由 流向 (填字母)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e‑ 转移,有 g 精铜析出。
科目:gzhx 来源:2009-2010学年聊城三中高二第二学期第四次阶段性测试化学试题 题型:选择题
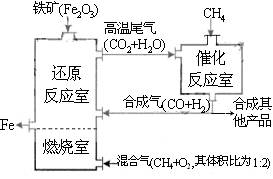
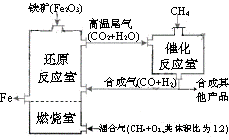
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) ∆H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g) ∆H1=+216kJ/mol;CH4(g)+ CO2(g) 2CO(g) + 2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol/L,n(CO)=bmol/L
n(H2)=cmol/L,则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源: 题型:
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ??H1=+216 kJ/mol;
CO(g)+3H2(g) ??H1=+216 kJ/mol;
CH4(g)+ CO2(g)![]() 2CO(g) + 2H2(g) ??H2=+260 kJ/mol
2CO(g) + 2H2(g) ??H2=+260 kJ/mol
(不考虑其他平衡的存在),下列说法正确的是( )
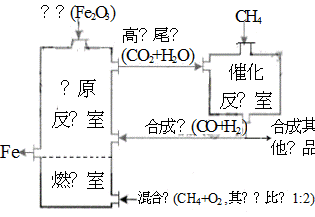
A.增大催化反应室的压强,甲烷的转化率减小
B.催化反应室需维持在550~750℃,目的仅是提高CH4 转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中平衡时,容器中c(CH4)=a mol·L-1, c(CO)=b mol·L-1,c(H2)=c mol·L-1
则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源: 题型:
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:
CH4(g)+H2O(g)CO(g)+3H2(g) ∆H1=+216kJ/mol;
CH4(g)+CO2(g)2CO(g) + 2H2(g) ∆H2=+260kJ/mol
(不考虑其他平衡的存在),下列说法正确的是( )
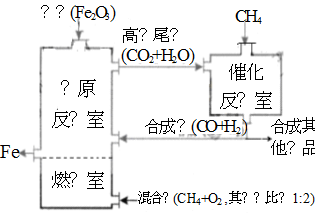
A.增大催化反应室的压强,甲烷的转化率减小
B.催化反应室需维持在550~750℃,目的仅是提高CH4 转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中平衡时,容器中c(CH4)=a mol·L-1, c(CO)=bmol·L-1,c(H2)=c mol·L-1
则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源:2012-2013学年广东省潮州市高三上学期期末质检理综化学试卷(解析版) 题型:计算题
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g) 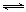 CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
CO2(g) + 3H2(g)
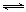 CH3OH(g)
+ H2O(g) ΔH2
CH3OH(g)
+ H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)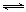 CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
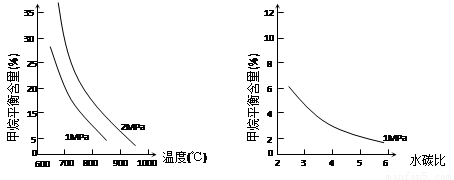
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
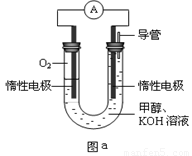
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。
科目:gzhx 来源: 题型:
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)![]() 2CO(g) + 2H2(g); △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g); △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol,n(CO)=bmol
n(H2)=cmol,则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源:2012-2013学年广东省揭阳市高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g)
ΔH = +206.2 kJ/mol
CO(g) + 3H2(g)
ΔH = +206.2 kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g)
ΔH = +165.0kJ/mol
CO2(g) +4H2(g)
ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
① 反应热ΔH(填“>”、“<”或“=”)_______0。
② 在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。

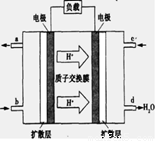
(3)已知甲烷燃料电池的工作原理如下图所示。该电池工作时,a口放出的物质为_________,该电池正极的电极反应式为:____ ,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有 mol 电子发生转移。
科目:gzhx 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:填空题
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g) 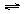 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
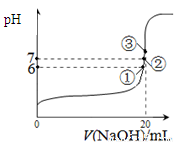
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
科目:gzhx 来源:浙江省五校2009-2010学年度高三第一次联考(化学)试题 题型:选择题
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:
CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+216
kJ/mol;
CO(g)+3H2(g) ∆H1=+216
kJ/mol;
CH4(g)+
CO2(g) 2CO(g) + 2H2(g) ∆H2=+260
kJ/mol
2CO(g) + 2H2(g) ∆H2=+260
kJ/mol
(不考虑其他平衡的存在),下列说法正确的是( )
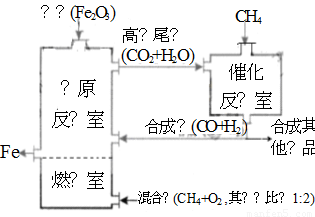
A.增大催化反应室的压强,甲烷的转化率减小
B.催化反应室需维持在550~750℃,目的仅是提高CH4 转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中平衡时,容器中c(CH4)=a mol·L-1, c(CO)=b mol·L-1,c(H2)=c mol·L-1
则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源:山东省聊城三中2009-2010学年高二下学期第四次阶段性测试化学试题 题型:013
|
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)
| |
| [ ] | |
A. |
增大催化反应室的压强,甲烷的转化率减小 |
B. |
催化室需维持在550~750℃,目的仅是提高CH4转化的速率 |
C. |
设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应 |
D. |
若催化反应室中,达到平衡时,容器中n(CH4)=a mol/L,n(CO)=b mol/L n(H2)=c mol/L,则通入催化反应室的CH4的物质的量为a+(b+c)/4 |
科目:gzhx 来源:0110 模拟题 题型:单选题
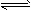 CO(g)+3H2(g)
CO(g)+3H2(g) 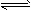 2CO(g) + 2H2(g) △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g) △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是 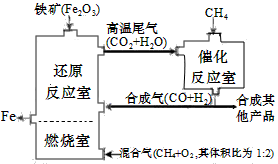
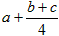 mol
mol 科目:gzhx 来源: 题型:
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ∆H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g) ∆H1=+216kJ/mol;CH4(g)+ CO2(g)![]() 2CO(g) + 2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol/L,n(CO)=bmol/L
n(H2)=cmol/L,则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源: 题型:
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216kJ/mol;CH4(g)+ CO2(g)
2CO(g) + 2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol/L,n(CO)=bmol/L
n(H2)=cmol/L,则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源: 题型:
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ??H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g) ??H1=+216kJ/mol;CH4(g)+ CO2(g)![]() 2CO(g) + 2H2(g) ??H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g) ??H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol/L,n(CO)=bmol/L
n(H2)=cmol/L,则通入催化反应室的CH4的物质的量为a+(b+c)/4
科目:gzhx 来源:专项题 题型:单选题
 CO(g)+3H2 (g) △H1=
CO(g)+3H2 (g) △H1= 2CO(g)+2H2(g) △H2=+260 kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g)+2H2(g) △H2=+260 kJ/mol(不考虑其他平衡的存在),下列说法正确的是 
科目:gzhx 来源:上海市十三校2012届高三第二次联考化学试题 题型:038
某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:
CH4(g)+H2(g)![]() CO(g)+3H2(g)……①(反应中CH4转化率为1)
CO(g)+3H2(g)……①(反应中CH4转化率为1)
2CO4(g)+O2(g)![]() 2CO(g)+4H2(g)……②(反应中CH4转化率为1)
2CO(g)+4H2(g)……②(反应中CH4转化率为1)
CO(g)+2H2(g)![]() CH3OH(g)……(反应中CO转化率为2/3)
CH3OH(g)……(反应中CO转化率为2/3)
合成工艺如下:

请回答下列问题(所有气体体积均折算为标准状况):
1.若只用反应器①来直接合成甲醇.当充入反应器①的甲烷和水蒸汽的体积分别为672 m3和2240 m3时,反应剩余物中CO为________mol、H2为________mol;
2.若CH4同时和H2O(g)及O2(g)反应,则am3CH4按上述两式完全反应,产物气体的体积V的范围为________.
3.若充入反应器①的甲烷和水蒸汽的体积分别为l体积和3体积,反应剩余物中:V(H2)∶V(N2)∶V(CO)=3∶1∶1.则充入反应器②的富氧空气(只含N2和H2)的体积为________;富氧空气中氧气体积分数为________.
4.若将25%的富氧空气、CH4和H2O(g)混合并充分反应,反应的产物中n(H2)/n(N2)=3∶1,来合成氨气,则反应中的H2O(g)和富氧空气的物质的量之比为________.
科目:gzhx 来源:模拟题 题型:填空题
 H2+I2
H2+I2  CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: 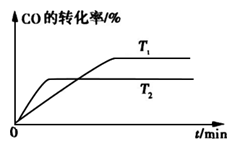
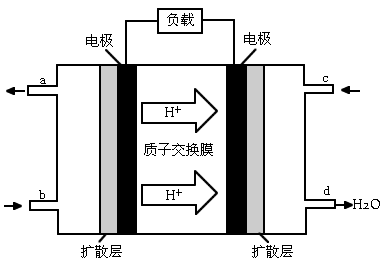
科目:gzhx 来源:江西省模拟题 题型:填空题
 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______科目:gzhx 来源:湖北省模拟题 题型:填空题
 H2+I2
H2+I2