
科目:czhx 来源: 题型:
A、+
| ||
B、+
| ||
C、+
| ||
D、+
|
科目:czhx 来源: 题型:多选题
科目:czhx 来源:2010年中考化学辅导跟踪练习试卷(3)(解析版) 题型:选择题
科目:czhx 来源: 题型:解答题

科目:gzhx 来源: 题型:
【化学——物质结构与性质】(15分)
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,
1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
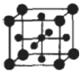
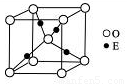
(4)E+的核外电子排布式为 ,图12是E的某种氧化物的晶胞结构示意图,氧的配位数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
科目:gzhx 来源:2011-2012学年江西省六校高三联考理科综合试卷(化学部分) 题型:填空题
【化学——物质结构与性质】(15分)
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,
1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,图12是E的某种氧化物的晶胞结构示意图,氧的配位数为 。

(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
科目:gzhx 来源:不详 题型:填空题

科目:gzhx 来源: 题型:解答题
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |

科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、 N、 O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”下同)B;第一电离能: N O。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3) 。 FeTiO3与80%的硫酸反应可 生成TiOSO4。SO42-的空间构型为 形,其中硫原子采用 杂化.
(4)磷酸钛〔Ti3 (PO4 )4]锂离子电池能量密度大、安全性高。Ti3 (PO4 )4可由TiOSO4与
 H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
则三分子H3PO4脱去两分子H2O生成三磷酸,其结构式为 ,四分子H3PO4 脱去四分子H2O生成的四偏磷酸属于 元酸。
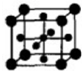
(5)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 个O2-相紧邻.
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCI型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1)中,若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28X10-10 m,则FexO中x=_。

科目:gzhx 来源: 题型:
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、 N、 O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”下同)B;第一电离能: N O。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3) 。 FeTiO3与80%的硫酸反应可 生成TiOSO4。SO42-的空间构型为 形,其中硫原子采用 杂化.
(4)磷酸钛〔Ti3 (PO4 )4]锂离子电池能量密度大、安全性高。Ti3 (PO4 )4可由TiOSO4与
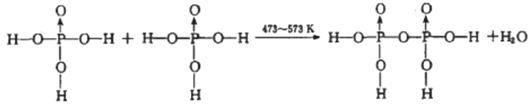 H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
则三分子H3PO4脱去两分子H2O生成三磷酸,其结构式为 ,四分子H3PO4 脱去四分子H2O生成的四偏磷酸属于 元酸。
(5)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 个O2-相紧邻.
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCI型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1)中,若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28X10-10 m,则FexO中x=_。
科目:gzhx 来源: 题型:
 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).科目:gzhx 来源: 题型:
 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基科目:gzhx 来源: 题型:
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
科目:gzhx 来源:2011-2012学年江苏省苏北四市(徐、连、淮、宿)高三元月调研测试化学试卷 题型:填空题
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
科目:gzhx 来源:不详 题型:填空题

科目:gzhx 来源: 题型:
某课外兴趣小组为了探究某种铝合金(合金元素为Mg)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计了下图装置进行实验。
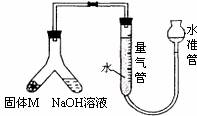
(1)如何检验该装置是否密封____________________;
(2)固体M与氢氧化钠溶液反应的离子方程式_______;
(3)倾斜A使氢氧化钠溶液(足量)与合金粉末(固体M)ag充分反应,待反应停止后,反应后进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M的质量应_________;
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积____(填“>”、“<”、“=”) VmL。若a =38mg,V=44.8mL,该合金________(填“符合”、“不符合”)国家标准;
(5)另一兴趣小组利用该装置测定Mg的相对原子质量。需要直接测定的物理量为______;
a.加入稀硫酸(浓度已知)的体积 b.镁条的质量 c.量气管读数
若测定结果偏小,可能的原因是_____________。
a.镁条表面氧化膜未除尽 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却即读取量气管读数 d.装置漏气
科目:gzhx 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(18分) A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1) G的基态原子的外围电子排布式为_____________________________________,在周期表中属于________区。
(2) B与F形成的一种非极性分子的电子式为_________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为___________。
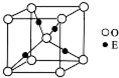
(3) BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。

(4) 设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液
③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5) 丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6) A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________。
(7) 往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是__。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO 与PO
与PO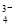 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
科目:gzhx 来源:2016届西藏日喀则地区一中高三10月月考理综化学试卷(解析版) 题型:填空题
【化学一物质结构与性质】(15分)周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基志原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:

(1)写出Z的基态原子外围电子排布__________。
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如上图所示:在Am-中,R原子轨道杂化类型有_______;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为____________。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是_______。
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为____g•cm-3。(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
科目:gzhx 来源:2016届江苏省宿迁市三校高三9月学情调研化学试卷(解析版) 题型:填空题
(18分)A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1)G的基态原子的外围电子排布式为__________,在周期表中属于________区。
(2)B与F形成的一种非极性分子的电子式为__________;F的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。
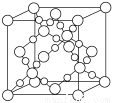
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为____________。
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:_______________。
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是_______。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体