
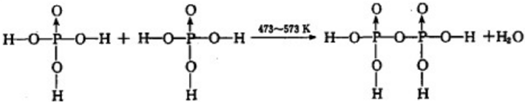
| 1 |
| 2 |
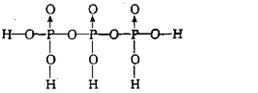 ;
; ;四;
;四;| 4 |
| NA |


科目:高中化学 来源: 题型:
| A、稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被氧化的元素与被还原的元素质量比为1:4 |
| B、NaBH4既是氧化剂又是还原剂 |
| C、NaBH4是还原剂,H2O是氧化剂 |
| D、硼元素被氧化,氢元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH=2 |
| B、c(Na+)=0.01 mol/L≥c(B2-) |
| C、c (H+)?c(OH-)=10-14 |
| D、c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| B、用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率 |
| C、用量筒量取10.00mL 1.00mol?L-1盐酸于100mL容量瓶中,加水稀释至刻度,可配制0.100 mol?L-1盐酸 |
| D、除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
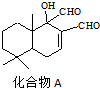
| A、化合物A分子中含有手性碳原子 |
| B、1mol化合物A与H2加成时最多可消耗1mol H2 |
| C、化合物A分子中所有碳原子共平面 |
| D、化合物A在浓硫酸作用下加热可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33.3% | B、40% |
| C、50% | D、66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②③⑥ |
| C、④⑥ | D、③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com