
科目:czsx 来源:2013年江苏省海门市中考二模数学试卷(带解析) 题型:解答题
已知二次函数 中,其函数
中,其函数 与自变量
与自变量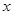 之间的部分对应值如下表所示:
之间的部分对应值如下表所示:
| x | …… | 0 | 1 | 2 | 3 | 4 | 5 | …… |
| y | …… | 4 | 1 | 0 | 1 | 4 | 9 | …… |
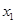 ,
,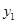 )、B(
)、B( ,
,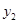 )在该函数的图象上,则当
)在该函数的图象上,则当
 时,
时,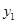 与
与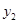 的大小关系是 ;
的大小关系是 ; 的图象上,问:当m<-3时,y1、y2、y3的值一定能作为同一个三角形三边的长吗?为什么?=】
的图象上,问:当m<-3时,y1、y2、y3的值一定能作为同一个三角形三边的长吗?为什么?=】 科目:czsx 来源:2013年江苏省海门市中考二模数学试卷(解析版) 题型:解答题
已知二次函数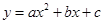 中,其函数
中,其函数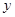 与自变量
与自变量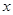 之间的部分对应值如下表所示:
之间的部分对应值如下表所示:
|
x |
…… |
0 |
1 |
2 |
3 |
4 |
5 |
…… |
|
y |
…… |
4 |
1 |
0 |
1 |
4 |
9 |
…… |
(1)当x=-1时,y的值为 ;
(2)点A(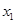 ,
,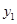 )、B(
)、B( ,
,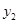 )在该函数的图象上,则当
)在该函数的图象上,则当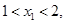
 时,
时,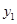 与
与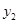 的大小关系是 ;
的大小关系是 ;
(3)若将此图象沿x轴向右平移3个单位,请写出平移后图象所对应的函数关系式: ;
(4)设点P1(m,y1)、P2(m+1,y2)、P3(m+2,y3)都在二次函数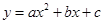 的图象上,问:当m<-3时,y1、y2、y3的值一定能作为同一个三角形三边的长吗?为什么?=】
的图象上,问:当m<-3时,y1、y2、y3的值一定能作为同一个三角形三边的长吗?为什么?=】
科目:czsx 来源:不详 题型:解答题
 中,其函数
中,其函数 与自变量
与自变量 之间的部分对应值如下表所示:
之间的部分对应值如下表所示:| x | …… | 0 | 1 | 2 | 3 | 4 | 5 | …… |
| y | …… | 4 | 1 | 0 | 1 | 4 | 9 | …… |
 ,
, )、B(
)、B( ,
, )在该函数的图象上,则当
)在该函数的图象上,则当
 时,
时, 与
与 的大小关系是 ;
的大小关系是 ; 的图象上,问:当m<-3时,y1、y2、y3的值一定能作为同一个三角形三边的长吗?为什么?=】
的图象上,问:当m<-3时,y1、y2、y3的值一定能作为同一个三角形三边的长吗?为什么?=】科目:gzhx 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol ②2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
③C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO的原理如图1,A为电源的 极,阴极反应式为 。

(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
科目:czsx 来源:江苏省无锡市惠山区2012届九年级下学期期中考试数学试题 题型:022
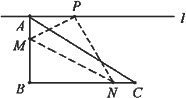
如图在三角形纸片ABC中,已知∠ABC=90°,AC=5,BC=4,过点A作直线l平行于BC,折叠三角形纸片ABC,使直角顶点B落在直线l上的点P处,折痕为MN,当点P在直线l上移动时,折痕的端点M、N也随之移动,若限定端点M、N分别在AB、AC边上(包括端点)移动,则线段AP长度的最大值与最小值的差为________.
科目:czsx 来源:2013届浙江省温州市育英学校九年级第二学期开学考试数学试卷(带解析) 题型:解答题
如图,已知直线 与
与 轴,
轴, 轴分别相交于点
轴分别相交于点 .点
.点 从点
从点 出发沿射线
出发沿射线 以每秒1个单位长的速度匀速运动,同时点
以每秒1个单位长的速度匀速运动,同时点 从点
从点 出发沿
出发沿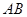 以每秒1个单位长的速度向点
以每秒1个单位长的速度向点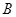 匀速运动.当点
匀速运动.当点 到达点
到达点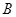 时停止运动,点
时停止运动,点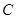 也随之停止.连结
也随之停止.连结 ,
, 交
交 轴于点
轴于点 .记
.记 的中点
的中点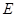 关于
关于 轴的对称点为
轴的对称点为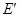 .设点
.设点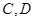 运动的时间是秒(
运动的时间是秒( ).
).
(1)当 时,则
时,则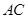 = ,点
= ,点 的坐标为 ;
的坐标为 ;
(2)当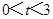 时,若记四边形BDCO的面积为S,则求S关于的函数解析式
时,若记四边形BDCO的面积为S,则求S关于的函数解析式
(3)当直线EF与△ABO的一边垂直时,求的值;
(4)当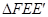 为等腰直角三角形时,请直接写出的值
为等腰直角三角形时,请直接写出的值
科目:czsx 来源:2012-2013学年浙江省九年级第二学期开学考试数学试卷(解析版) 题型:解答题
如图,已知直线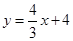 与
与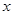 轴,
轴, 轴分别相交于点
轴分别相交于点 .点
.点 从点
从点 出发沿射线
出发沿射线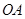 以每秒1个单位长的速度匀速运动,同时点
以每秒1个单位长的速度匀速运动,同时点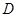 从点
从点 出发沿
出发沿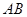 以每秒1个单位长的速度向点
以每秒1个单位长的速度向点 匀速运动.当点
匀速运动.当点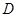 到达点
到达点 时停止运动,点
时停止运动,点 也随之停止.连结
也随之停止.连结 ,
, 交
交 轴于点
轴于点 .记
.记 的中点
的中点 关于
关于 轴的对称点为
轴的对称点为 .设点
.设点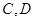 运动的时间是秒(
运动的时间是秒(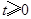 ).
).

(1)当 时,则
时,则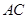 = ,点
= ,点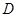 的坐标为 ;
的坐标为 ;
(2)当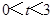 时,若记四边形BDCO的面积为S,则求S关于的函数解析式
时,若记四边形BDCO的面积为S,则求S关于的函数解析式
(3)当直线EF与△ABO的一边垂直时,求的值;
(4)当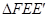 为等腰直角三角形时,请直接写出的值
为等腰直角三角形时,请直接写出的值
科目:czsx 来源:不详 题型:解答题
 与
与 轴,
轴, 轴分别相交于点
轴分别相交于点 .点
.点 从点
从点 出发沿射线
出发沿射线 以每秒1个单位长的速度匀速运动,同时点
以每秒1个单位长的速度匀速运动,同时点 从点
从点 出发沿
出发沿 以每秒1个单位长的速度向点
以每秒1个单位长的速度向点 匀速运动.当点
匀速运动.当点 到达点
到达点 时停止运动,点
时停止运动,点 也随之停止.连结
也随之停止.连结 ,
, 交
交 轴于点
轴于点 .记
.记 的中点
的中点 关于
关于 轴的对称点为
轴的对称点为 .设点
.设点 运动的时间是秒(
运动的时间是秒( ).
).
 时,则
时,则 = ,点
= ,点 的坐标为 ;
的坐标为 ; 时,若记四边形BDCO的面积为S,则求S关于的函数解析式
时,若记四边形BDCO的面积为S,则求S关于的函数解析式 为等腰直角三角形时,请直接写出的值
为等腰直角三角形时,请直接写出的值科目:czhx 来源:2013届江苏省扬州市九年级上学期期中考试化学试卷(带解析) 题型:探究题
(本题共12分)“爆竹声中一岁除”燃放烟花爆竹是中华民族文化的重要组成部分,然而,近年灰我国许多大、中城市都对烟花爆竹实施了“禁放”或者“限放”,民族文化为什么受到限制,好奇心驱使小明,小强、小亮三位同学,他们决定对烟花爆竹进行展开实验探究。
【提出问题】烟花爆竹燃放时会产生什么气体?
【查阅资料】1.我国传统的黑火药的标准配方为:硝酸钾75% 、硫磺l0% 、木炭l5%,因为黑火药中的硫磺成分具有着火温度低、燃速快等性质,因而使黑火药容易点火,使得在生产过程中硫的使用量过大。
2.CO2和SO2均能使石灰水变浑浊;
【猜想】烟花爆竹燃放时会产生CO2和SO2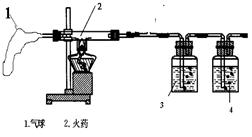
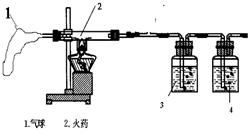
【实验过程】他们设计的实验探究过程如右图
实验开始前应先检查 ,再点燃酒精灯,已知2处为从爆竹中取出的少量的火药,根据实验设计要求应当还要用到 色的高锰酸钾溶液和石灰水,则3中应放的是 ,4中应放的是 ,若猜想正确, 4中发生反应的化学方程式是 。结果证明原猜想正确。
【实验反思】
1、装置中气球的作用是 ,
2、已知 硬质玻璃管中发生的反应有S +2KNO3+3C === 3CO2 +N2 + X ,则X的化学式为 。该玻璃管中还发生的反应 (写化学方程式)搞清烟花爆竹的基本原理和实验中产生的气体之后,该兴趣小组又利用春节期间测定市区某烟花爆竹集中燃放点处二氧化硫的含量
【查阅资料】1、可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:
SO2+I2+2H2O=H2SO4+2HI。
【测定装置】:甲同学设计了如下图所示的实验装置:
【测定步骤】:
(一) 配制一定浓度的稀碘溶液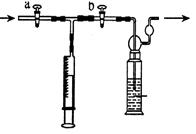
(二)、二氧化硫含量的测定
(1)将一定浓度、一定质量的稀碘溶液放于洗气瓶中,并滴入几滴稀淀粉溶液,此时洗瓶中溶液的颜色为蓝色。(淀粉遇碘单质呈蓝色)
(2)3位同学分别设计好的装置来到燃放点,打开a, 关闭b用注射器抽取100 mL燃放点空气。再关闭a,打开b,再缓缓推动注射器,将气体全部推入滴有淀粉的碘水溶液中,重复上述操作多次,直到溶液刚好变成无色,记录抽气的次数。
(3)3位同学使溶液刚好变成无色时抽气的次数分别为50、60、65次, 次的最接近真实值,另两位同学不准确的原因为
(4)最终我们通过计算可以确定燃放点的二氧化硫含量是否超标。
【测定反思】
1.小明经过思考后认为在测定时可将右图所示的多孔球泡放入洗气瓶中,你认为加此仪器的好处是 。
2.小强同学认为:实验方案需要抽气的次数太多,操作麻烦。与小亮讨论后,决定对设计的实验加以调整,以减少抽气的次数,他们调整的方案可能是 。
3.三位同学经过对烟花爆竹的研究,明白了国家“禁放”的和“限放”的原因,你认为原因的是
A 减少噪声污染 B 减少固体废弃物污染 C 减少大气污染 D 减少粉尘污染
科目:czhx 来源:2012-2013学年江苏省扬州市九年级上学期期中考试化学试卷(解析版) 题型:探究题
(本题共12分)“爆竹声中一岁除”燃放烟花爆竹是中华民族文化的重要组成部分,然而,近年灰我国许多大、中城市都对烟花爆竹实施了“禁放”或者“限放”,民族文化为什么受到限制,好奇心驱使小明,小强、小亮三位同学,他们决定对烟花爆竹进行展开实验探究。
【提出问题】烟花爆竹燃放时会产生什么气体?
【查阅资料】1.我国传统的黑火药的标准配方为:硝酸钾75% 、硫磺l0% 、木炭l5%,因为黑火药中的硫磺成分具有着火温度低、燃速快等性质,因而使黑火药容易点火,使得在生产过程中硫的使用量过大。
2.CO2和SO2均能使石灰水变浑浊;
【猜想】烟花爆竹燃放时会产生CO2和SO2
【实验过程】他们设计的实验探究过程如右图
实验开始前应先检查 ,再点燃酒精灯,已知2处为从爆竹中取出的少量的火药,根据实验设计要求应当还要用到 色的高锰酸钾溶液和石灰水,则3中应放的是 ,4中应放的是 ,若猜想正确, 4中发生反应的化学方程式是 。结果证明原猜想正确。
【实验反思】
1、装置中气球的作用是 ,
2、已知 硬质玻璃管中发生的反应有S +2KNO3+3C === 3CO2 +N2 + X ,则X的化学式为 。该玻璃管中还发生的反应 (写化学方程式)搞清烟花爆竹的基本原理和实验中产生的气体之后,该兴趣小组又利用春节期间测定市区某烟花爆竹集中燃放点处二氧化硫的含量
【查阅资料】1、可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:
SO2+I2+2H2O=H2SO4+2HI。
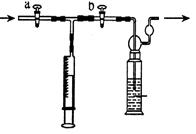
【测定装置】:甲同学设计了如下图所示的实验装置:
【测定步骤】:
(一) 配制一定浓度的稀碘溶液
(二)、二氧化硫含量的测定
(1)将一定浓度、一定质量的稀碘溶液放于洗气瓶中,并滴入几滴稀淀粉溶液,此时洗瓶中溶液的颜色为蓝色。(淀粉遇碘单质呈蓝色)
(2)3位同学分别设计好的装置来到燃放点,打开a, 关闭b用注射器抽取100 mL燃放点空气。再关闭a,打开b,再缓缓推动注射器,将气体全部推入滴有淀粉的碘水溶液中,重复上述操作多次,直到溶液刚好变成无色,记录抽气的次数。
(3)3位同学使溶液刚好变成无色时抽气的次数分别为50、60、65次, 次的最接近真实值,另两位同学不准确的原因为
(4)最终我们通过计算可以确定燃放点的二氧化硫含量是否超标。
【测定反思】
1.小明经过思考后认为在测定时可将右图所示的多孔球泡放入洗气瓶中,你认为加此仪器的好处是 。
2.小强同学认为:实验方案需要抽气的次数太多,操作麻烦。与小亮讨论后,决定对设计的实验加以调整,以减少抽气的次数,他们调整的方案可能是 。
3.三位同学经过对烟花爆竹的研究,明白了国家“禁放”的和“限放”的原因,你认为原因的是
A 减少噪声污染 B 减少固体废弃物污染 C 减少大气污染 D 减少粉尘污染
科目:czhx 来源:不详 题型:实验题



科目:gzhx 来源: 题型:
通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO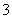 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
科目:gzhx 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。
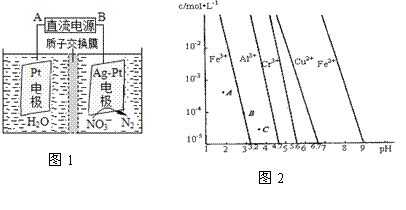

(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
科目:gzhx 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。
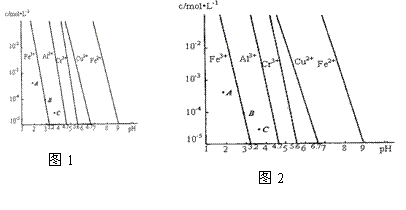

(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
科目:czhx 来源: 题型:阅读理解
“爆竹声中一岁除”燃放烟花爆竹是中华民族文化的重要组成部分,然而,近年灰我国许多大、中城市都对烟花爆竹实施了“禁放“或者”限放“,民族文化为什么受到限制,好奇心驱使小明,小强、小亮三位同学,他们决定对烟花爆竹进行展开实验探究。
【提出问题】烟花爆竹燃放时会产生什么气体?
【查阅资料】1.我国传统的黑火药的标准配方为:硝酸钾75% 、硫磺l0% 、木炭l5%,因为黑火药中的硫磺成分具有着火温度低、燃速快等性质,因而使黑火药容易点火,使得在生产过程中硫的使用量过大。
2.CO2和SO2均能使石灰水变浑浊;
【猜想】烟花爆竹燃放时会产生CO2和SO2
【实验过程】他们设计的实验探究过程如右图
实验开始前应先检查 ,再点燃酒精灯,已知2处为从爆竹中取出的少量的火药,根据实验设计要求应当还要用到 色的高锰酸钾溶液和石灰水,则3中应放的是 ,4中应放的是 ,若猜想正确, 4中发生反应的化学方程式是 。结果证明原猜想正确,
【实验反思】
1、装置中气球的作用是 ,
2、已知 硬质玻璃管中发生的反应有S +2KNO3 +3C === 3CO2 +N2 + X ,则X的化学式为 。该玻璃管中还发生的反应 (写化学方程式)搞清烟花爆竹的基本原理和实验中产生的气体之后,该兴趣小组又利用春节期间测定市区某烟花爆竹集中燃放点处二氧化硫的含量
【查阅资料】1、可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:
SO2+I2+2H2O=H2SO4+2HI。
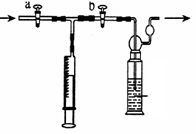
【测定装置】:甲同学设计了如下图所示的实验装置:
【测定步骤】:
(一) 配制一定浓度的稀碘溶液
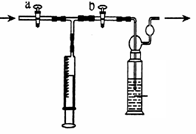 (二)、二氧化硫含量的测定
(二)、二氧化硫含量的测定
(1)将一定浓度、一定质量的稀碘溶液放于洗气瓶中,并滴入几滴稀淀粉溶液,此时洗瓶中溶液的颜色为蓝色。(淀粉遇碘单质呈蓝色)
(2)3位同学分别设计好的装置来到燃放点,打开a, 关闭b用注射器抽取100 mL燃放点空气。再关闭a,打开b,再缓缓推动注射器,将气体全部推入滴有淀粉的碘水溶液中,重复上述操作多次,直到溶液刚好变成无色,记录抽气的次数
(3)3位同学使溶液刚好变成无色时抽气的次数分别为50、60、65次, 次的最接近真实值,另两位同学不准确的原因为
(4)最终我们通过计算可以确定燃放点的二氧化硫含量是否超标。
 【测定反思】
【测定反思】
1.小明经过思考后认为在测定时可将右图所示的多孔球泡放入洗气瓶中,你认为加此仪器的好处是 。
2.小强同学认为:实验方案需要抽气的次数太多,操作麻烦。与小亮讨论后,决定对设计的实验加以调整,以减少抽气的次数,他们调整的方案可能是  。
。
3.三位同学经过对烟花爆竹的研究,明白了国家“禁放”的和“限放”的原因,你认为原因的是
A 减少噪声污染 B 减少固体废弃物污染 C 减少大气污染 D 减少粉尘污染
科目:czhx 来源: 题型:阅读理解
“爆竹声中一岁除”燃放烟花爆竹是中华民族文化的重要组成部分,然而,近年灰我国许多大、中城市都对烟花爆竹实施了“禁放“或者”限放“,民族文化为什么受到限制,好奇心驱使小明,小强、小亮三位同学,他们决定对烟花爆竹进行展开实验探究。
【提出问题】烟花爆竹燃放时会产生什么气体?
【查阅资料】1.我国传统的黑火药的标准配方为:硝酸钾75% 、硫磺l0% 、木炭l5%,因为黑火药中的硫磺成分具有着火温度低、燃速快等性质,因而使黑火药容易点火,使得在生产过程中硫的使用量过大。
2.CO2和SO2均能使石灰水变浑浊;
【猜想】烟花爆竹燃放时会产生CO2和SO2
【实验过程】他们设计的实验探究过程如右图
实验开始前应先检查 ,再点燃酒精灯,已知2处为从爆竹中取出的少量的火药,根据实验设计要求应当还要用到 色的高锰酸钾溶液和石灰水,则3中应放的是 ,4中应放的是 ,若猜想正确, 4中发生反应的化学方程式是 。结果证明原猜想正确,
【实验反思】
1、装置中气球的作用是 ,
2、已知 硬质玻璃管中发生的反应有S +2KNO3 +3C === 3CO2 +N2 + X ,则X的化学式为 。该玻璃管中还发生的反应 (写化学方程式)搞清烟花爆竹的基本原理和实验中产生的气体之后,该兴趣小组又利用春节期间测定市区某烟花爆竹集中燃放点处二氧化硫的含量
【查阅资料】1、可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:
SO 2+I2+2H2O=H2SO4+2HI。
2+I2+2H2O=H2SO4+2HI。
【测定装置】:甲同学设计了如下图所示的实验装置:
【测定步骤】:
(一) 配制一定浓度的稀碘溶液
 (二)、二氧化硫含量的测定
(二)、二氧化硫含量的测定
(1)将一定浓度、一定质量的稀碘溶液放于洗气瓶中,并滴入几滴稀淀粉溶液,此时洗瓶中溶液的颜色为蓝色。(淀粉遇碘单质呈蓝色)
(2)3位同学分别设计好的装置来到燃放点,打开a, 关闭b用注射器抽取100 mL燃放点空气。再关闭a ,打开b,再缓缓推动注射器,将气体全部推入滴有淀粉的碘水溶液中,重复上述操作多次,直到溶液刚好变成无色,记录抽气的次数
,打开b,再缓缓推动注射器,将气体全部推入滴有淀粉的碘水溶液中,重复上述操作多次,直到溶液刚好变成无色,记录抽气的次数
(3)3位同学使溶液刚好变成无色时抽气的次数分别为50、60、65次, 次的最接近真实值,另两位同学不准确的原因为
(4)最终我们通过计算可以确定燃放点的二氧化硫含量是否超标。
 【测定反思】
【测定反思】
1.小明经过思考后认为在测定时可将右图所示的多孔球泡放入洗气瓶 中,你认为加此仪器的好处是 。
中,你认为加此仪器的好处是 。
2.小强同学认为:实验方案需要抽气的次数太多,操作麻烦。与小亮讨论后,决定对设计的实验加以调整,以减少抽气的次数,他们调整的方案可能是 。
3.三位同学经过对烟花爆竹的研究,明白了国家“禁放”的和“限放”的原因,你认为原因的是
A 减少噪声污染 B 减少固体废弃物污染 C 减少大气污染 D 减少粉尘污染
科目:gzhx 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
科目:gzhx 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
科目:gzhx 来源:贵州省云峰中学2010届高三下学期3月月考化学试题 题型:022
物质A中只含有C、H、O三种元素,能发生银镜反应.物质C的相对分子质量为104.A与其他物质之间的转化关系如下图所示:
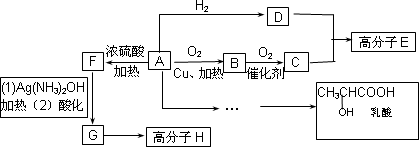
已知:(1)有机物之间的转化关系以及转化过程相对分子质量变化如下:
物质转化关系:RCH2OH RCHO RCOOH
相对分子质量:M M-2 M+14
(2)RCH![]() CH2+HBr
CH2+HBr![]() RCH(Br)CH3
RCH(Br)CH3
回答下列问题:
(1)H结构简式_______________.
(2)一定条件下B发生银镜反应的化学方程式为:_______________.
(3)C、D在一定条件下反应还能生成八元环状物,其化学反应方程式为_______________.
(4)在有机合成中,很多复杂的有机物都是从碳原子数小于或等于4有机物合成的.其中有机物F可以从甲烷合成得到,他的第一步反应是甲烷与氯气的取代反应,若此反应理论上欲获得最多的氯化氢,设V(Cl2)/V(CH4)=x,则x的取值范围是________.
(5)请设计合理方案从A合成乳酸(用反应流程图表示,并注明反应条件).
例:由乙醇合成聚乙烯的反应流程图可表示为:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]()
![]()
科目:gzhx 来源: 题型:
(15分)
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。
Ⅰ.MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH为下表所示。

(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2
的物质的量之比应为 。
(2)步骤二中b的值为 。
(3)步骤三中洗涤干净的标准是 。
Ⅱ.用MnFe2O4热化学循环制氢:
MnFe2O4(s)→MnFe2O(4-x)(s) + ![]() O2(g);△H1
O2(g);△H1
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
请回答下列问题:
(4) 若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为 。
(5)该热化学循环制氢的优点有 (填序号)。
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
则:△H3与△H1、△H2的关系为△H3= 。