
科目:gzhx 来源:2016届福建省高一上学期第二次月考化学试卷(解析版) 题型:实验题
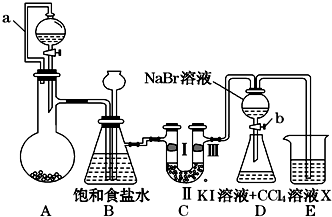
(13分)下图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略)。

⑴若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式: ;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓) =5Cl2↑+2MnCl2 +2KCl+8H2O
该反应中的氧化剂是 ,若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是 mol;
⑵装置B中饱和食盐水的作用是 ;
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到D中无色溶液逐渐变为________色,若打开D装置的活塞,使D中溶液滴入E装置(KI溶液与CCl4),振荡锥形瓶后静置一会儿,可以观察到的现象是 ;
⑸装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式 。
科目:gzhx 来源: 题型:解答题

| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
科目:gzhx 来源: 题型:解答题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
科目:gzhx 来源:2015-2016学年福建省宁德市高二下期末化学试卷(解析版) 题型:实验题
某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。

图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。


图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。
科目:gzhx 来源: 题型:
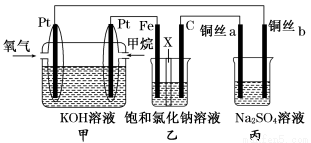
 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:科目:gzhx 来源: 题型:解答题
 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
科目:gzhx 来源: 题型:实验题

| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
科目:gzhx 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是: 。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极, 发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
科目:gzhx 来源: 题型:
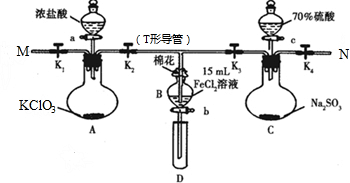
下图是某兴趣小组在实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)实验室制备氯气的化学方程式为_____________________________________________,
该反应的氧化剂是____________。
(2)装置B中饱和食盐水的作用是______________________________________________;
同时装置B亦是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:________________________________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________(填“a”、“b”、“c”或“d”)。
| a | b | c | d | |
| Ⅰ | 干燥的有 色布条 | 干燥的有 色布条 | 湿润的有 色布条 | 湿润的有 色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有 色布条 | 湿润的有 色布条 | 干燥的有 色布条 | 干燥的有 色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性强弱。
向装置D中缓缓通入少量氯气时,可以看到________,说明氯的非金属性大于溴。打开活塞,将装置D中的少量溶液加入装置E中,振荡。观察到E中溶液分为两层,上层(苯层)为紫红色,说明溴的非金属性______碘。
(5)下列装置中可以代替装置F的是________。

科目:gzhx 来源:2017届江西省高三上学期10月月考化学试卷(解析版) 题型:实验题
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
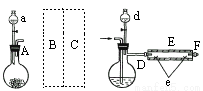
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性_____________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是_____________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明: ;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为: 。
科目:gzhx 来源: 题型:阅读理解

| 溴 | 物理性质 | 暗红色液体,刺激性气味.室温下易挥发.熔点-7.2℃,沸点59.1℃.密度2.928g・cm-3.稍溶于冷水. |
| 化学性质 | 溶于水生成次溴酸 |
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2SO4 |
| △ |
科目:gzhx 来源: 题型:
完成下列问题:
(1)如何检查装置A的气密性:__________________。
(2)实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,观察到的现象是__________________________;滴加盐酸时,发现反应速率较相同浓度盐酸与铁粉反应要快,其原因是________________________________________________________________。
(3)待A中的物质反应完成后,打开b,进行过滤,滤液过滤到盛有过氧化氢的烧杯中,发生反应的化学方程式为:________________________________。
(4)要从烧杯内溶液得到FeCl3·6H2O晶体,主要操作包括:_________________________________________________。
(5)实验室若没有过氧化氢,可用下列 _________试剂代替(填选项)。
A.过量稀硝酸 B.过量氯水 C.过量氨水 D.过量氢氧化钠溶液
(6)若要测废铁屑中铁的纯度,测出放出气体的体积V(已折算成标准状况,单位:L),则废铁屑的纯度为 _________(用m、V的代数式表示)。
科目:gzhx 来源: 题型:阅读理解
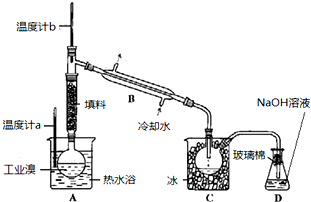
某研究性学习小组进行溴乙烷的制备及性质探究实验。

探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A. 氢氧化钠稀溶液 B. 碳酸钠稀溶液
C. 硝酸银溶液 D. 四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图
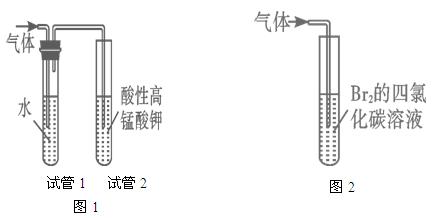
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
科目:gzhx 来源: 题型:阅读理解
某研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A. 氢氧化钠稀溶液 B. 碳酸钠稀溶液
C. 硝酸银溶液 D. 四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
科目:gzhx 来源:2011届四川省南充高中高三第四次月考化学试卷 题型:实验题
某研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |
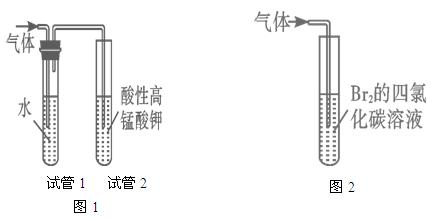
科目:gzhx 来源:2010-2011学年四川省高三第四次月考化学试卷 题型:实验题
某研究性学习小组进行溴乙烷的制备及性质探究实验。

探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A. 氢氧化钠稀溶液 B. 碳酸钠稀溶液
C. 硝酸银溶液 D. 四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图

请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
科目:gzhx 来源: 题型:实验题
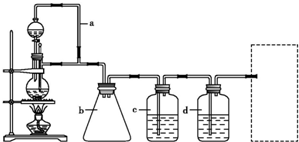
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2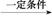 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。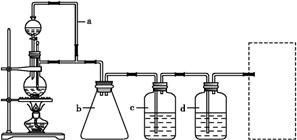
请填写下列空白:
(1)写出实验室制备氢气的化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中b的作用分别是 ; C中盛装的试剂是 。若用以上装置制备H2,在虚线框内画出收集H2干燥的装置图。
(3)制丙烯时,还产生少量SO2, CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①足量饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
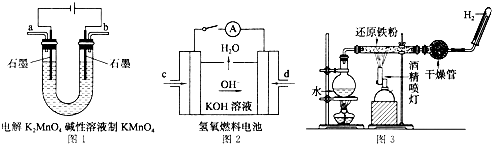
(4)下图所示装置工作时均与H2有关。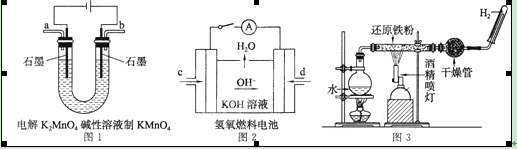
①图1所示装置中阳极的电极反应式为 。
②图2所示装置中,通入H2的管口是 (选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论 (填“严密”或“不严密”),你的理由是 (用离子方程式表示)。
科目:gzhx 来源: 题型:
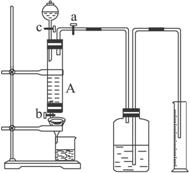
某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3・6H2O,并测定该废屑中铁的纯度,设计了下列实验装置图。A中放有m克废铁屑,烧杯中盛有过量的过氧化氢溶液。

完成下列问题:
(1)如何检查装置A的气密性: 。
(2)实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,观察到的现象是 ;滴加盐酸时,发现反应速率较相同浓度盐酸与铁粉反应要快,其原因是 。
(3)待A中的物质反应完成后,打开b,进行过滤,滤液过滤到盛有过氧化氢的烧杯中,发生反应的化学方程式为: 。
(4)要从烧杯内溶液得到FeCl3・6H2O晶体,主要操作包括:
(5)实验室若没有过氧化氢,可用下列 试剂代替(填选项)。
A.过量稀硝酸 B.过量氯水 C.过量氨水 D.过量氢氧化钠溶液
(6)若要测废铁屑中铁的纯度,测出放出气体的体积V(实验中导管体积忽略不计,已折算成标准状况,单位:L),则废铁屑纯度为 (用m、V的代数式表示)