科目:czhx 来源: 题型:阅读理解
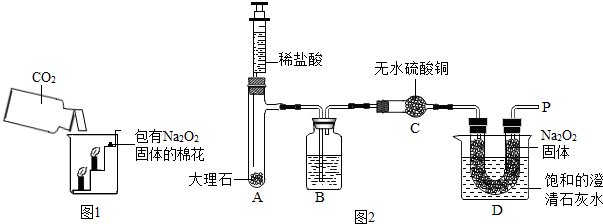
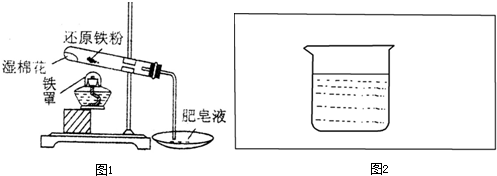
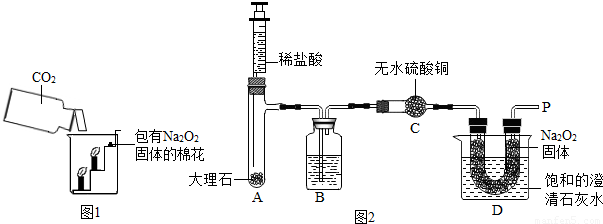
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、  。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
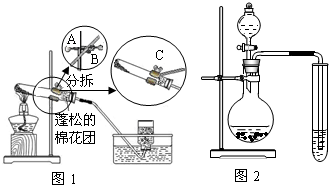
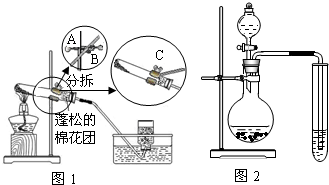
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
 | |||
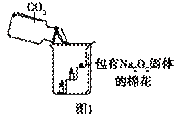 | |||
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放 置一根带火星的木条,观察现
置一根带火星的木条,观察现 象。
象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实 验结论】
验结论】 ①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式  。
。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
科目:czhx 来源: 题型:阅读理解
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,![]() 同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、 ![]() 。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
 【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
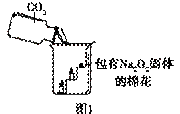 |
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ![]() ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式 。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
科目:czhx 来源:2010年江苏省镇江市丹阳六中中考化学三模试卷(解析版) 题型:解答题

| 实验方案 | 实验现象 | 实验结论 |
| ①取样,先向溶液中滴加过量的________溶液. | 产生白色沉淀 | 粉末中既有NaOH也有Na2CO3 |
| ②静置,取上层清液,滴加________溶液. | 产生蓝色沉淀 |
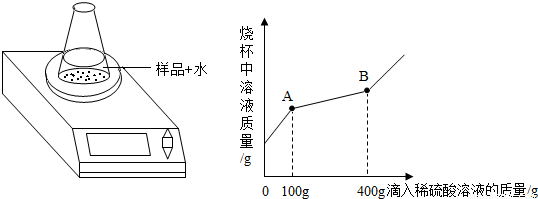

科目:czhx 来源: 题型:阅读理解
 30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.

科目:czwl 来源: 题型:实验探究题
科目:gzhx 来源: 题型:

| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
科目:czhx 来源: 题型:阅读理解

| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |
| ||
| ||
科目:gzhx 来源: 题型:
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).科目:czhx 来源: 题型:阅读理解
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 |
| 收集过程分析 | 集满现象: |
“验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ① | |
科目:czhx 来源: 题型:解答题

| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 |
| 收集过程分析 | 集满现象: | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ①;②; | |
科目:czhx 来源:不详 题型:问答题
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且______ |
| 收集过程分析 | 集满现象:______ | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ①______;②______; | |
科目:czhx 来源:2012届江苏省南通市海安县紫石中学九年级适应性考试化学试卷(带解析) 题型:探究题
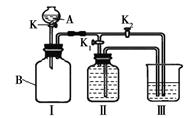
(13分)化学是一门以实验为基础的学科,通过一年的学习,相信你的实验能力一定有了很大提高,请你一同参与回答以下问题。
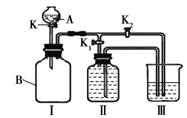
(一)某实验小组设计了下图所示的实验装置。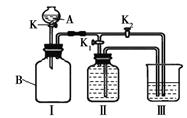
⑴ 写出仪器A的名称
⑵ 甲同学认为打开K1、关闭K2时,利用I、Ⅱ装置,可以制取并收集氧气,该化学反应方程式为 : 。
⑶乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量。关闭K、K1、K2,用凸透镜引燃B中的白磷,待冷却后打开K2,整个实验过程中能观察到的现象是:① ;② 。
⑷ 丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳能与氢氧化钠溶液发生反应。他在广口瓶B中预先收集满二氧化碳气体,在仪器A中盛放氢氧化钠浓溶液,烧杯中盛放稀盐酸, K1关闭、K2打开,然后打开K将氢氧化钠浓溶液滴入广口瓶中,关闭K,依据 现象,可以证明二氧化碳能与氢氧化钠溶液发生化学反应。
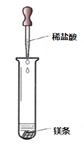
(二)甲、乙两同学对有关镁与盐酸的反应进行了系列研究(如图)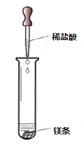
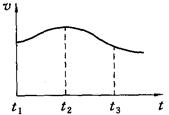
探究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:`
⑴实验时需将镁条进行打磨,其目的是 。
⑵反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,化学方程式为 。
⑶实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,你认为在t1~t2时间内反应速率逐渐加快的主要原因是: 。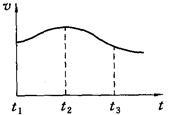
探究二:.反应后所得溶液的酸碱性探究
【发现问题】
⑴反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性,(选填“酸”“碱”或“中”)。
⑵反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,溶液变红。
【查阅资料】氢氧化镁微溶于热水,且溶解度随温度升高而增大。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;
猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液呈碱性使酚酞变成红色;
猜想Ⅱ:镁与热水反应后生成碱使酚酞变红色。
【实验与思考】
⑴为验证猜想,甲、乙两同学均需测定____溶液的酸碱性,实验表明该溶液显弱酸性。
⑵乙同学为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧,请根据以上现象写出镁与热水反应的化学方程式 ;
⑶乙同学在进行上述猜想Ⅱ的探究时,发现实验一段时间后,酚酞的红色总是会逐渐消失,于是他猜想可能是镁与热水反应后生成的碱逐渐被空气中的二氧化碳反应掉了,但甲同学猜想可能是水温逐渐降低,导致 ,请你设计一个简单的实验方案验证甲或乙的猜想是否成立 (写出相应的操作、现象和结论): 。
【结论】
镁与稀盐酸反应,若镁反应完全后所得溶液显酸性,若镁过量时所得溶液显碱性。
科目:czhx 来源:2011-2012学年江苏省南通市九年级适应性考试化学试卷(解析版) 题型:探究题
(13分)化学是一门以实验为基础的学科,通过一年的学习,相信你的实验能力一定有了很大提高,请你一同参与回答以下问题。
(一)某实验小组设计了下图所示的实验装置。
⑴ 写出仪器A的名称
⑵ 甲同学认为打开K1、关闭K2时,利用I、Ⅱ装置,可以制取并收集氧气,该化学反应方程式为 : 。
⑶乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量。关闭K、K1、K2,用凸透镜引燃B中的白磷,待冷却后打开K2,整个实验过程中能观察到的现象是:① ;② 。
⑷ 丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳能与氢氧化钠溶液发生反应。他在广口瓶B中预先收集满二氧化碳气体,在仪器A中盛放氢氧化钠浓溶液,烧杯中盛放稀盐酸, K1关闭、K2打开,然后打开K将氢氧化钠浓溶液滴入广口瓶中,关闭K, 依据 现象,可以证明二氧化碳能与氢氧化钠溶液发生化学反应。
(二)甲、乙两同学对有关镁与盐酸的反应进行了系列研究(如图)
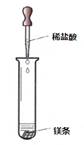
探究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:`
⑴实验时需将镁条进行打磨,其目的是 。
⑵反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,化学方程式为 。
⑶实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,你认为在t1~t2时间内反应速率逐渐加快的主要原因是: 。
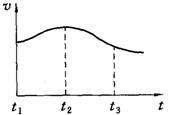
探究二:.反应后所得溶液的酸碱性探究
【发现问题】
⑴反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 性,(选填“酸”“碱”或“中”)。
⑵反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,溶液变红。
【查阅资料】氢氧化镁微溶于热水,且溶解度随温度升高而增大。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;
猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液呈碱性使酚酞变成红色;
猜想Ⅱ:镁与热水反应后生成碱使酚酞变红色。
【实验与思考】
⑴为验证猜想,甲、乙两同学均需测定____溶液的酸碱性,实验表明该溶液显弱酸性。
⑵乙同学为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧,请根据以上现象写出镁与热水反应的化学方程式 ;
⑶乙同学在进行上述猜想Ⅱ的探究时,发现实验一段时间后,酚酞的红色总是会逐渐消失,于是他猜想可能是镁与热水反应后生成的碱逐渐被空气中的二氧化碳反应掉了,但甲同学猜想可能是水温逐渐降低,导致 ,请你设计一个简单的实验方案验证甲或乙的猜想是否成立 (写出相应的操作、现象和结论): 。
【结论】
镁与稀盐酸反应,若镁反应完全后所得溶液显酸性,若镁过量时所得溶液显碱性。
科目:czhx 来源:不详 题型:实验题
科目:czhx 来源:2012年江苏省无锡市滨湖中学中考化学二模试卷(解析版) 题型:解答题
科目:czhx 来源: 题型:阅读理解