
科目:gzhx 来源: 题型:阅读理解
| 2n-7 |
| 2n+1 |
| 2n-7 |
| 2n+1 |
科目:gzhx 来源: 题型:
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
科目:gzhx 来源:江苏省梅村高级中学2012届高三12月双周练化学试题 题型:058
高氯酸铜[Cu(C1O4)2·6H2O,摩尔质量:371 g/mol]易溶于水,120℃开始分解,常用于生产电极和作燃烧的催化剂等.实验室制备少量高氯酸铜的步骤如下:
(1)制备纯净的硫酸铜称取15 g粗CuSO4(含Fe2+)放人小烧杯中,加入50 mL蒸馏水,搅拌.滴人少量稀硫酸,再滴加2 mL 3%的H2O2溶液,充分反应.将溶液冷却,逐滴加入0.5~1 mol·L-1的NaOH溶液,直到pH=3.5~4,过滤,滤液转移到洁净的蒸发皿中,用稀硫酸将溶液pH调至1-2,再经蒸发、结晶、洗涤、晾干得精制的硫酸铜晶体.
①加入酸化的过氧化氢溶液,发生反应的离子方程式为________.
②过滤与蒸发过程中都用到的玻璃仪器是________.
(2)用(1)制得的精制硫酸铜晶体,制备高纯度的Cu(C1O4)2·6H2O,请补充实验步骤.该实验可选用的试剂有:70%HClO4溶液,Na2CO3·OH2O,盐酸酸化的氯化钡溶液.
a.称取7.0 g CuSO4·5H2O和8.0 g Na,CO3·10H2O,混合研细后,投入100 mL沸水,快速搅拌,静置得绿色沉淀.
b.过滤,用少量蒸馏水洗涤沉淀________次.
c.用________检验沉淀是否洗涤干净.
d.在沉淀中慢慢滴加70% HC1O4溶液,搅拌至________为止.
e.过滤,得蓝色高氯酸铜溶液.
f.在通风橱中蒸发至不再产生白雾,继续蒸发至有晶膜出现,________,得蓝色晶体.
g.60℃下,在烘箱中干燥2h,得Cu(C1O4)2·6H2O晶体8.4 g.
①补充实验步骤b、c、d和f.
②本次实验产率为________.
③某温度下,高氯酸铜同时按两种方式分解:
Cu(C1O4)2![]() CuCl2+4O2↑(A)
CuCl2+4O2↑(A)
2Cu(ClO4)2![]() 2CuO+7O2↑十+2C12↑(B)
2CuO+7O2↑十+2C12↑(B)
若测得V(O2)/V(Cl2)=n,则按(A)式分解的高氯酸铜的质量分数为________(用含n的代数式表示).
科目:gzhx 来源: 题型:解答题
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
科目:gzhx 来源: 题型:
高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
(1)写出实验室制取高氯酸钾的化学方程式:___ _。
(2)用蒸馏水多次洗涤晶体的目的是______________ __。
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体, I、使固体全部溶解。II、在100oC时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体![]() 。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品
。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品![]() 。IV、重结晶得KNO3纯品
。IV、重结晶得KNO3纯品![]() 。
。
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10oC | 80.5 | 20.9 | 35.7 | 31.0 |
| 100oC | 175 | 246 | 39.1 | 56.6 |
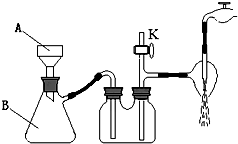
①操作III中采用减压过滤,装置如右图所示,仪器A和B的名称分别是
,
②该装置有三处错误,分别是
,
③若实验过程中发现倒吸现象,应采取的措施是 。
(4) KNO3晶体纯品的产率 。 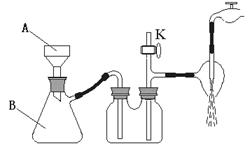
科目:czhx 来源: 题型:
科目:czhx 来源: 题型:
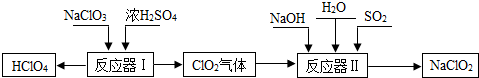
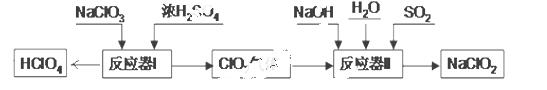
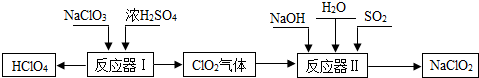
高氯酸(HClO4)和亚氯酸钠(NaClO2)在工业上有广泛的用途,其制备工艺流程如下:
请回答下列问题:
(1)HClO4中Cl元素的化合价是 。
(2)反应器I中的生成物有HClO4、ClO2、NaHSO4、H2O,其中属于氧化物的是 。
(3)反应器II中发生反应的化学方程式为2ClO2+SO2+4NaOH=2NaClO2+X+2H2O,则X的化学式是 。
科目:czhx 来源: 题型:
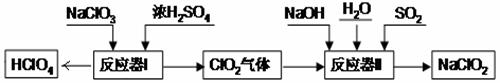
高氯酸(HClO4)和亚氯酸钠(NaClO2)在工业上有广泛的用途,其制备工艺流程如下:
请回答下列问题:
(1)HC lO4中Cl元素的化合价是 。
lO4中Cl元素的化合价是 。
(2)反应器I中的生成物有HClO4、ClO2、NaHSO4、H2O,其中属于氧化物的是
(3)反应器II中发生反应的化学方程式为2ClO2+SO2+4NaOH=2NaClO2+X+2H2O,则X的化学式是 。
科目:czhx 来源:2016年初中毕业升学考试(江苏无锡卷)化学(解析版) 题型:填空题
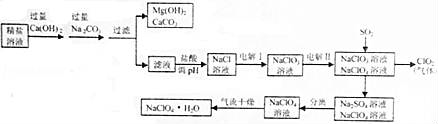
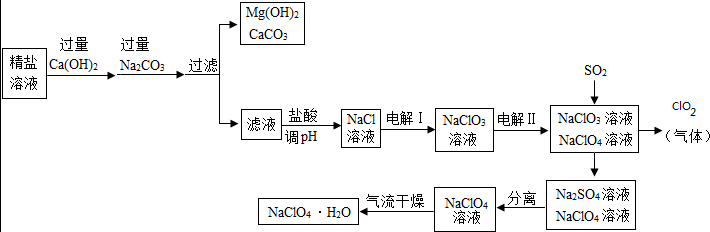
高氯酸钠晶体(NaClO4•H2O)可用于制备高氯酸。粗盐除去泥沙等不容性杂质后得到“精盐”(只含MgCl2、CaCl2两种杂质),以“精盐”为原料制备高氯酸钠晶体的流程如下:
【资料】高氯酸钠在较高温度下容易分解。
请回答下列问题:
(1)滤液中溶质除NaCl外还含有 。
(2)ClO2中氧元素的化合物是 。
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,该反应的化学方程式为 。
(4)“气流干燥”时温度应控制在75°C~95°C之间,其原因是 。
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
科目:gzhx 来源: 题型:实验题
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
科目:gzhx 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:实验题
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
金属离子 | 开始沉淀 | 沉淀完全 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.7 | 6.7 |
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
科目:gzhx 来源:不详 题型:实验题
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
科目:czhx 来源: 题型:解答题
科目:czhx 来源: 题型:解答题
科目:czhx 来源: 题型:推断题

科目:gzhx 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:填空题
(12分)高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
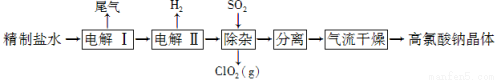
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
科目:gzhx 来源: 题型:解答题
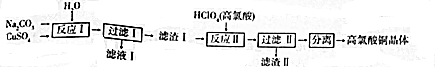
科目:gzhx 来源: 题型:解答题
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |