
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
| A、将NaF溶液与浓硫酸混合共热制取氟化氢气体 | ||||
B、工业上:H2+Cl2
| ||||
| C、实验室用浓磷酸与溴化钠共热制溴化氢气体 | ||||
| D、实验室用碘化钠与浓硫酸共热制碘化氢气体 |
科目:gzhx 来源: 题型:
A.将浓硫酸与卤化物共热制取卤化氢
B.用制取氯化氢的装置制备氟化氢
C.贮存液溴应水封,并用玻璃塞
D.氢氟酸应用带塑料塞的玻璃瓶保存
科目:gzhx 来源:2012-2013学年江苏省扬州市高三下学期5月考前适应性考试化学试卷(解析版) 题型:实验题
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH) n (SO4) 3-n/2]m (n>2 , m≤10)的实验流程如下:
 已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
(1)实验加入硫酸的作用是 。取样分析Fe2+浓度,其目的是 。
(2)用pH试纸测定溶液pH的操作方法为 。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数 。(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是 。
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]
 [Fe2(OH)n(SO4)
3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4)
3-n/2 ] m,则水解反应的化学方程式为 。
(5)产品盐基度的测定方法:
Ⅰ 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V ml。
Ⅳ 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 ml。
①达到滴定终点的现象为 。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为 。
科目:gzhx 来源: 题型:单选题
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH) n (SO4) 3-n/2]m (n>2 , m≤10)的实验流程如下:
已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
(1)实验加入硫酸的作用是 。取样分析Fe2+浓度,其目的是 。
(2)用pH试纸测定溶液pH的操作方法为 。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数 。(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是 。
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]  [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
(5)产品盐基度的测定方法:
Ⅰ 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V ml。
Ⅳ 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 ml。
①达到滴定终点的现象为 。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为 。
科目:gzhx 来源:不详 题型:单选题

 [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。科目:gzhx 来源: 题型:
| 3-n |
| 2 |

| n(OH-) |
| 3n(Fe) |
科目:gzhx 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:实验题
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)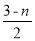 ]m(n>2,m≤10)的实验流程如下:
]m(n>2,m≤10)的实验流程如下:

已知:盐基度=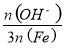 ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是____________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]⇌[Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol•L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为____________。
科目:gzhx 来源:2011-2012学年安徽省蚌埠市三年级第一次教学质量检查考试化学试卷(解析版) 题型:选择题
.如图所示是制备药物氧氟沙星的中间体,它不能发生的反应类型是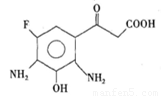
A.加成反应 B.取代反应
C.水解反应 D.加聚反应
科目:gzhx 来源: 题型:单选题
 Fe2O3+3H2
Fe2O3+3H2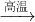 2Fe+Al2O3
2Fe+Al2O3科目:gzhx 来源:2013年北京市丰台区高考化学二模试卷(解析版) 题型:选择题
 Fe2O3+3H2
Fe2O3+3H2 2Fe+Al2O3
2Fe+Al2O3科目:gzhx 来源:2012届安徽省蚌埠市三年级第一次教学质量检查考试化学试卷(解析版) 题型:单选题
.如图所示是制备药物氧氟沙星的中间体,它不能发生的反应类型是
| A.加成反应 | B.取代反应 |
| C.水解反应 | D.加聚反应 |
科目:gzhx 来源: 题型:021
下列方法可用于制备卤化氢气体的是
[ ]
A.NaCl与浓硝酸共热制备氯化氢
B.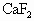 与浓硫酸共热制备氟化氢
与浓硫酸共热制备氟化氢
C.NaBr与浓磷酸共热制备溴化氢
D.NaI与浓硫酸共热制备碘化氢