
科目:czhx 来源: 题型:实验探究题

| 配料 | 含碘(I)量 | 保质期 | 食用方法 | 贮藏指南 |
| 氯化钠、碘酸钾 | 20mg~40mg/kg | 18个月 | 勿长时间炖炒 | 避热、避光、密封 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量固体,加水搅拌 | 固体溶解形成无色溶液 | |
| 取少许溶液,加入过量稀硝酸、振荡 | 有气泡产生 | 含有碳酸钠 |
| 在上述溶液中加入硝酸银溶液、振荡 | 有白色沉淀产生 | 含有氯化钠 |
科目:gzhx 来源:2014-2015学年江西省高三4月联考理综化学试卷(解析版) 题型:实验题
(14分)Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I 实验原理:Na2SO3(aq)+S(s)△ Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
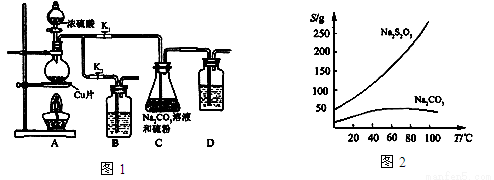
III 实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式: 。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过 、 、过滤、洗涤、烘干,可得粗产品Na2S2O3·5H2O。
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯。测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯。再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为____ mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果 (填“偏高”“偏低”或“不变”)。
科目:czhx 来源: 题型:
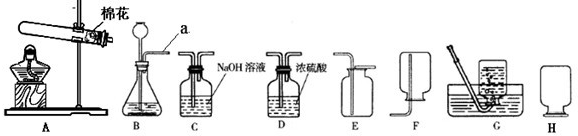
现有下列实验装置,请根据要求回答:
(1)实验室若使用盐酸和金属锌制取氢气,化学反应方程式为_____________ _ ___,
 这种方法制得的氢气往往含有少量氯化氢气体,原因是_________ _____,
这种方法制得的氢气往往含有少量氯化氢气体,原因是_________ _____,
可将气体通过装置_________________除去氯化氢气体;
(2)写出使用AE 装置制取气体的化学反应方程式: 
 。
。
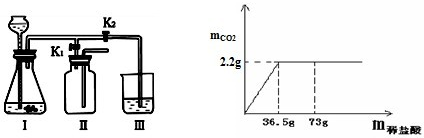
(3)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质。
 ①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
(填字母)。
a.大理石与稀盐酸反应制取收集二氧化碳
b.锌与稀硫酸反应制取收集氢气
c.用氯酸钾与二氧化锰共同加热制取收集氧气
②当打开K2、关闭K1时,可以利用Ⅰ、Ⅲ装置制得二氧化碳并验证其性质。若要证明二氧化碳能与水发生反应,应向烧杯的水中加入 。
(4)现有7.5g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如下图所示。(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)该石灰石样品中碳酸钙的质量分数是多少?
 |
科目:czhx 来源: 题型:解答题


科目:czhx 来源: 题型:
| ||
| ||
科目:gzhx 来源: 题型:解答题
