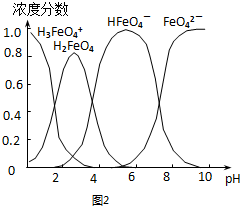
科目:gzhx 来源: 题型:解答题
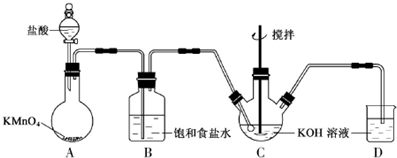
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:实验题

科目:czhx 来源: 题型:解答题
科目:gzhx 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:实验题
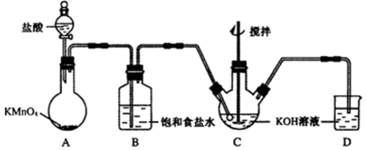
高铁酸钾(K2FeO4)是一种绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。
查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是 。
(3)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是 。
(4)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式 ;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是 。
(5)制得的粗产品中含有Fe(OH)3、KCl等杂质。提纯方案:将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式) 、 ,过滤时不用普通漏斗而采用砂芯漏斗的原因是 。
②晶体用乙醇洗涤的原因是 。
科目:gzhx 来源:2017届黑龙江省高三10月月考化学卷(解析版) 题型:实验题
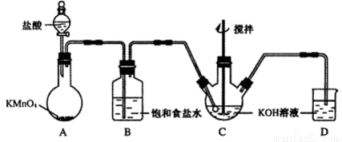
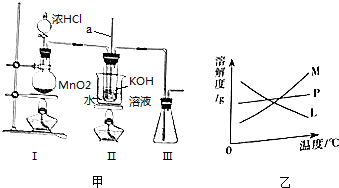
高铁酸钾(K2FeO4)是一种绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。

查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生 成Fe(OH)3和O2。请回答下列问题:
成Fe(OH)3和O2。请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是 。
(3)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是 。
(4)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式 ;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是 。
(5)制得的粗产品中含有Fe(OH)3、KCl 等杂质。提纯方案:将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置
等杂质。提纯方案:将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置 ,再用砂芯漏斗过滤,晶体用适量乙醇洗涤
,再用砂芯漏斗过滤,晶体用适量乙醇洗涤 2~3次后,在真空干燥箱中干燥。
2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式) 、 ,过滤时不用普通漏斗而采用砂芯漏斗的原因是(用离子方程式说明) 。
②晶体用乙醇洗涤的原因是 。
科目:gzhx 来源: 题型:实验题
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

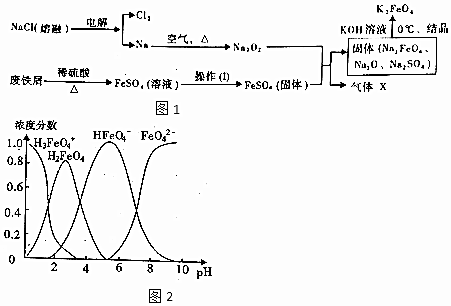
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:实验题