
科目:gzhx 来源: 题型:
反应N2(g) +3H2(g)=2NH3(g),起始时,N2的浓度为3mol·L-1,H2的浓度为5mol·L-1,3min后测得NH3浓度为0.6mol·L-1,则此时间段内,下列反应速率表示正确的是:
A.v(NH3)= 0.2mol·L-1·S-1 B. v(N2)= 1.0mol·L-1·min-1
C. v(H2)= 1.67mol·L-1·min-1 D. v(H2)= 0.3mol·L-1·min-1
科目:gzhx 来源:2012-2013学年山东省济宁市鱼台一中高二3月月考化学试卷(带解析) 题型:单选题
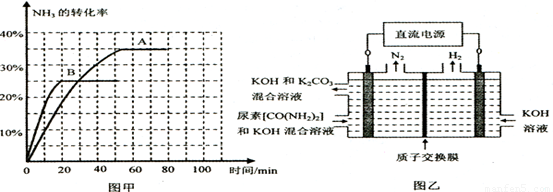
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )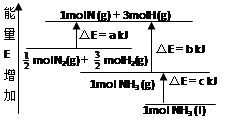
| A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1 |
C.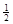 N2(g)+ N2(g)+ H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1 H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1 |
D.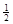 N2(g)+ N2(g)+ H2(g)=NH3(g); △H=(a+b)kJ·mol H2(g)=NH3(g); △H=(a+b)kJ·mol |
科目:gzhx 来源:2014届山东省济宁市高二3月月考化学试卷(解析版) 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )

A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+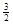 H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
D. N2(g)+
N2(g)+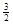 H2(g)=NH3(g);
△H=(a+b)kJ·mol
H2(g)=NH3(g);
△H=(a+b)kJ·mol
科目:gzhx 来源:2013-2014学年湖北省荆州市毕业班质量检查(一)化学试卷(解析版) 题型:填空题
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g)
△H=一92. 4 KJ·mol-1
2NH3(g)
△H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g)
+3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g)
+3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
A.①③④ B.①②④⑤ C.①④⑤ D.②③④
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
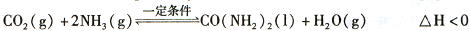
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
|
时间/min |
0 |
30 |
70 |
80 |
100 |
|
n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )

A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
D.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g); △H=(a+b)kJ·mol
H2(g)=NH3(g); △H=(a+b)kJ·mol
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )
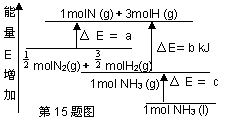
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
D.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g); △H=(a+b)kJ·mol
H2(g)=NH3(g); △H=(a+b)kJ·mol
科目:gzhx 来源: 题型:
下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)

A.4NH3(g)+ 5O2(g)=4NO(g)+6H2O(g) B.N2(g)+3H2(g)=2NH3(g)
△H = -a KJ·mol-1 △H = -b KJ·mol-1

C.2SO3=2SO2(g)+ O2(g) D.2N2O5(g) = 4NO2(g) + O2(g)
△H = +c KJ·mol-1 △H = +d KJ·mol-1
科目:gzhx 来源:知识精讲与能力训练 高三化学 题型:043
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通.如图所示,容器中发生反应N2(气)+3H2(气)![]() 2NH3(气)△H<0,若反应达到平衡后,测得混合气体为7体积.据此回答下列问题:
2NH3(气)△H<0,若反应达到平衡后,测得混合气体为7体积.据此回答下列问题:
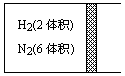
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体体积及各物质的体积分数仍与上述平衡完全相同,那么:
①若a=1,c=2则b=________,此时该反应向________方向进行.(填“正反应”、“逆反应”)
②若规定起始时反应向逆反应进行,则c的取值范围是________.
(2)在上述装置中,若使平衡后混合气体变为6.5体积,可采取的措施是________,简述理由________.
科目:gzhx 来源:三点一测丛书 高中化学(选修)化学反应原理 江苏版课标本 江苏版课标本 题型:022
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生以下反应N2(气)+3H2(气)![]() 2NH3(气)ΔH=-Q(Q>0)若达平衡后,测得混合气体积为7体积,据此回答下面问题:
2NH3(气)ΔH=-Q(Q>0)若达平衡后,测得混合气体积为7体积,据此回答下面问题:
(1)保持上述反应温度不变,设a,b,c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡时,各物质组成的含量与上述平衡完全相同.
①若a=1,c=2,则b=________,在此情况下,反应起始时将向方向移动.
②若需规定起始时反应向逆方向进行,则c的范围是________.
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是________,其理由是________.
科目:gzhx 来源:黑龙江省牡丹江一中2011-2012学年高二上学期期末考试化学试题 题型:022
科学家一直致力于“人工固氮”的方法研究.
(1)目前合成氨的技术原理为:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
该反应的能量变化如图所示.
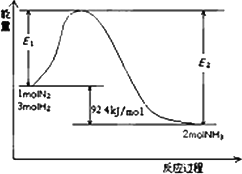
①在反应体系中加入催化剂,反应速率增大,E2的变化是:________.(填“增大”、“减小”或“不变”).
②将一定量的N2(g)和H2(g)放入2 L的密闭容器中,在500℃、2×107 Pa下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol.氮气的平均反应速率v(N2)=________,H2的转化率为________,该反应在此温度下的化学平衡常数为________.(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是________.
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
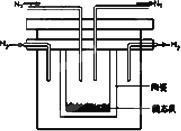
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨.其实验装置如图所示.阴极的电极反应式为________.
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g);ΔH=a kJ/mol
4NH3(g)+3O2(g);ΔH=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
![]()
此合成反应的a________0.(填“大于”、“小于”或“等于”)
科目:gzhx 来源:山东省临沂高新区实验中学2008-2009学年高三12月月考化学试题 人教版 人教版 题型:022
合成氨工业对化学工业和国防工业具有重要意义.
(1)常温下氨气极易溶于水,其水溶液可以导电.
①用方程式表示氨气溶于水的过程中存在的可逆过程__________________
②氨水中水电离出的c(OH-)________10-7 mol/L(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到依次为________.
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B.A为铵盐,B在标准状况下为气态.在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol A.
①写出氨气和氟气反应的化学方程式________;
②在标准状况下,每生成1 mol B,转移电子的物质的量为________mol.
(3)Ⅰ在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
达到平衡时,体积为反应前的三分之二.求:
①达到平衡时,N2的转化率为________.
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:①________②(填“>”、“<”或“=”)
Ⅱ若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.
③试比较平衡时NH3的浓度:Ⅰ________Ⅱ(填“>”、“<”或“=”).
科目:gzhx 来源: 题型:

| 3 | 4 |
科目:gzhx 来源: 题型:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应向 进行(填“左”或“右”),判断依据是 。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①该反应的化学平衡常数表达式为 ;
②反应达到平衡时,氢气的转化率 α(H2)= ;
③反应达到平衡后,下列措施能使![]() 增大的是 (填序号)。
增大的是 (填序号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g)
科目:gzhx 来源:2013-2014学年天津市七校高三12月联考化学试卷(解析版) 题型:选择题
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=−92. 4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3的浓度( mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C.α2+α3<1 D.Q3+92.4 c1=92.4
科目:gzhx 来源:2012-2013学年浙江省杭州二中高一下学期期中考试化学理科试卷(带解析) 题型:填空题
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2 ②各组分的物质的量浓度不再改变
③体系的压强不再发生变化 ④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2) 现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖。请用编号填写下列空白:
A.属于原子晶体的是_____________ ,其中熔点最高的是____________
B.属于分子晶体的是_____________________,其中分子构型为直线型的是____________ ,其电子式为_________________
C.含有非极性键的离子化合物是_______________,其中阳离子个数与阴离子个数之比为_________
科目:gzhx 来源:2014届山东省临沂市高二上学期期中考试化学试卷(解析版) 题型:选择题
将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气) NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
A.3.5mol/L B.4.5mol/L C.4mol/L D.5mol/L
科目:gzhx 来源:2011-2012学年江西省高三上学期第二次综合考试化学试卷 题型:填空题
(8分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)选择性催化还原法的脱硝原理为:6NOx+4x NH3  (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为________L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3 (g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=__________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
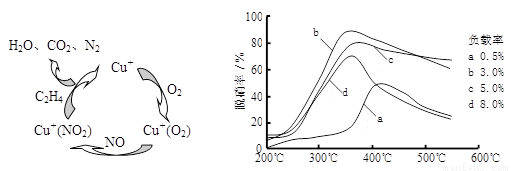

图1 图2
①写出该脱硝原理总反应的化学方程式:____________。
②为达到最佳脱硝效果,应采取的条件是____________。
科目:gzhx 来源: 题型:
(9分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是 。
⑵选择性催化还原法的脱硝原理为:
6NOx+4xNH3 ![]() (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O(g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH= 。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

图1 图2
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。