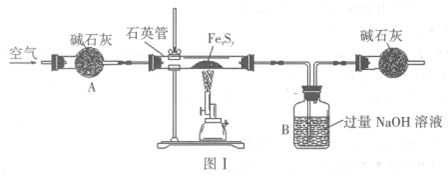
(2012?石家庄二模)氨是重要的化工产品之一,研究合成氨反应具有重要意义.σ
(1)已知断裂下列化学键需要吸收的能量分别为:N≡N 946.0kJ?mol
-1、H-H 436kJ?mol
-1、N-H 390.8kJ?mol
-1,写出以N
2(g)和H
2(g)为原料合成NH
3(g)的热化学方程式
N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ?mol-1
N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ?mol-1
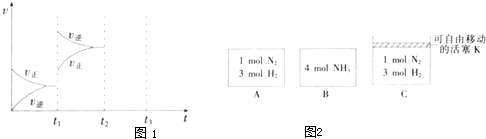
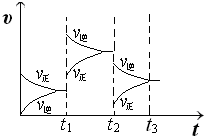
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如图1所示:
①t
1时刻改变的条件为
升高温度
升高温度
.
②t
2时刻,恒压充入氦气,t
3时刻达到平衡.在图中画出t
2时刻后的速率变化图象.
(3)相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图2所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡.
①达到平衡时,A、C两个容器中NH
3的浓度分别为c
1、c
2,则c
1<
<
c
2(填“>”、“<”或“=”).
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A)、α(B),则 α(A)+α(B)
<
<
1(填“>”、“<”或“=”).
③达到平衡时,若容器C的体积是起始时的
,则平衡时容器C中H
2的体积分数为
50%
50%
(4)直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH
3+3O
2═2N
2+6H
2O,则负极的电极反应式为
2NH3-6e-+6OH-═N2+6H2O
2NH3-6e-+6OH-═N2+6H2O
.


 ;
; ;
;