
科目:gzhx 来源: 题型:
 2NO(g)△H>0
2NO(g)△H>0| c2(NO) |
| c(N2)•c(O2) |
| c2(NO) |
| c(N2)•c(O2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |

科目:gzhx 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2V(N2)正=V(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
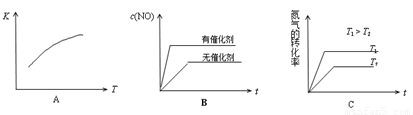
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
科目:gzhx 来源:不详 题型:问答题


科目:gzhx 来源:2012-2013学年辽宁省高三第五次模拟化学试卷(解析版) 题型:填空题
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g) 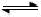 2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变)
科目:gzhx 来源:2012届北京市海淀区高三上学期期中练习化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭 容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L
和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向
正反应方向进行”或“向逆反应方向进行”),理由是
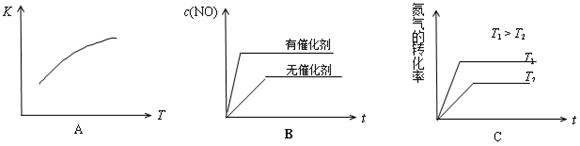
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。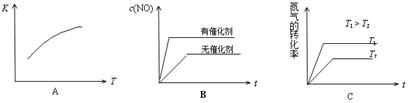
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入
一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的
体积分数 (填“变大、“变小”或“不变”)。
科目:gzhx 来源:2013届辽宁省东北育才双语学校高三第五次模拟化学试卷(带解析) 题型:填空题
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变)
科目:gzhx 来源:2012届江西省红色六校高三第一次联考化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
| A.消耗1molN2同时生成1molO2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2V(N2)正=V(NO)逆 |

科目:gzhx 来源:2011-2012学年宁夏银川一中高三(上)第四次月考化学试卷(解析版) 题型:解答题
 2NO(g)△H>0
2NO(g)△H>0
科目:gzhx 来源: 题型:
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g) 2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2V(N2)正=V(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
科目:gzhx 来源: 题型:022
在化工分析中常用到滴定度这个概念,所谓滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g×mL-1,现有一不溶于水的氧化亚铜样品,该样品能溶于用H2SO4酸化了的Fe2(SO4)3溶液中,所发生的反应可用化学方程式表示为2KMnO4+8H2SO4+10FeSO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O。若每升滴定剂溶液中含0.400mol KMnO4,求该KMnO4溶液对Cu2O滴定度。
NO是常见的大气污染物,它可以和血液中的血红蛋白结合,其亲和力比CO与血红蛋白的亲和力要大数百倍。
(1)汽车尾气中NO气体的来源是什么?
(2)NO使人中毒的根本原因是什么?
(3)目前治理NO污染的方法之一是:在400℃左右和有催化剂的情况下,用氨把NO还原为氮气和水,写出其化学方程式。
(4)根据国家环保局的统一规定,目前许多大城市进行常规大气监测的项目是:二氧化硫、氮氧化合物、悬浮颗粒物等三种大气污染物。简述城市空气质量预报对有关部门和普通市民有什么指导意义。
科目:gzhx 来源:物理教研室 题型:022
NO是常见的大气污染物,它可以和血液中的血红蛋白结合,其亲和力比CO与血红蛋白的亲和力要大数百倍。
(1)汽车尾气中NO气体的来源是什么?
(2)NO使人中毒的根本原因是什么?
(3)目前治理NO污染的方法之一是:在400℃左右和有催化剂的情况下,用氨把NO还原为氮气和水,写出其化学方程式。
(4)根据国家环保局的统一规定,目前许多大城市进行常规大气监测的项目是:二氧化硫、氮氧化合物、悬浮颗粒物等三种大气污染物。简述城市空气质量预报对有关部门和普通市民有什么指导意义。
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
(1)写出CO与NO反应的化学方程式_____________________________________________。
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是___________________。
(3)控制城市空气污染源的方法可以有___________________。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
科目:gzhx 来源: 题型:
(1)写出一氧化碳与一氧化氮反应的化学方程式:___________________________________。
(2)“催化转换器”的缺点是在一定程度上能提高空气的酸度,其原因是:________________。
(3)控制城市空气污染源的方法可以有______________ 。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
科目:gzhx 来源: 题型:
(7分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1) 写出一氧化碳与一氧化氮反应的化学方程式: 。
(2) “催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是
。
(3) 控制城市污染源的方法可以有 (多选扣分)
A. 开发氢能源 B.使用电动车 C.植树造林 D. 戴上呼吸面具
科目:gzhx 来源: 题型:
(1)写出一氧化碳与一氧化氮反应的化学方程式____________________。
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是_____________________。
(3)控制城市空气污染源的方法可以有_________。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
科目:gzhx 来源:2013-2014学年广东省等六校高三第三次联考理综化学试卷(解析版) 题型:填空题
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)
 2NO(g)
ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g)
ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2 ΔH=
(用含ΔH1、ΔH2的表达式表示);
O2+2NO(g) ΔH2 ΔH=
(用含ΔH1、ΔH2的表达式表示);
(2)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率 ;
(3)假定该反应是在恒容条件下进行,下列能判断该反应已达到平衡的是________;
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(4)下图是反应N2(g)+O2(g)  2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为
反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为
反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;

(5)T ℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol·L-1、0.20mol·L-1和0.50mol·L-1,此时反应N2(g)+O2(g)
 2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
科目:gzhx 来源: 题型:
(1)写出一氧化碳和一氧化氮反应的化学方程式:_____________________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是___________________。
(3)控制城市空气污染源的方法可以有_____________ (填序号)。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
科目:gzhx 来源:2014届陕西省西安市高一上学期期末化学试卷 题型:填空题
(8分)汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化。
(1)汽车尾气中NO的来源是 。
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出CO与NO反应的化学方程式: 。
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是
(4)控制或者减少城市汽车尾气污染的方法可以有 。(多选)
A.开发氢能源 B.使用电动车 C.限制车辆行驶 D.使用乙醇汽油