科目:gzhx 来源: 题型:
| ||
科目:gzhx 来源: 题型:阅读理解
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |

科目:gzhx 来源: 题型:
(13分)化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
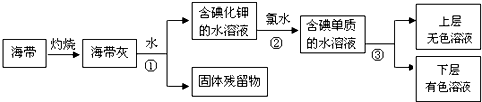
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示:
则:操作①的名称是 ,操作③使用的试剂(写化学式) 。操作② 中发生反应的离子方程式为 。
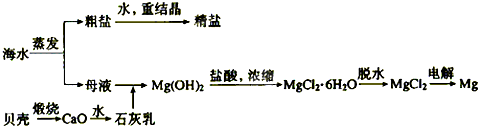
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为 。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式 ( )NaCl+( )H2O( )NaOH+H2↑+( )( )。
![]()
科目:gzhx 来源:2011-2012学年福建省三明市普通高中高一上学期联合命题考试化学试卷 题型:实验题
(13分)化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示: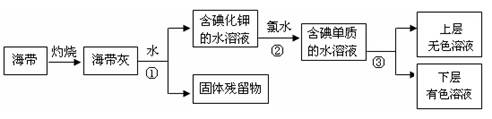
则:操作①的名称是 ,操作③使用的试剂(写化学式) 。操作②中发生反应的离子方程式为 。
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为 。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式( )NaCl+( )H2O  ( )NaOH+H2↑+( )( )。
( )NaOH+H2↑+( )( )。
科目:gzhx 来源:2010-2011学年云南省德宏州潞西市高三上学期期末统一测试化学试卷 题型:实验题
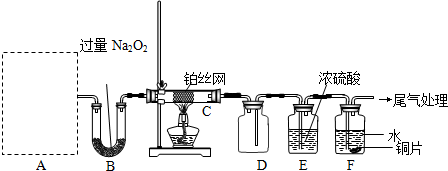
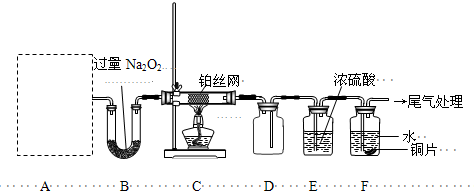
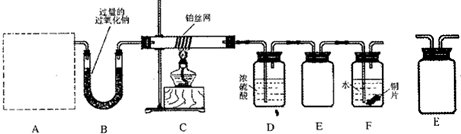
(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
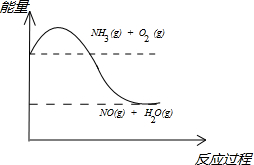
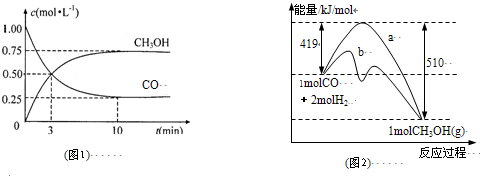
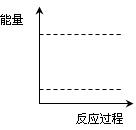
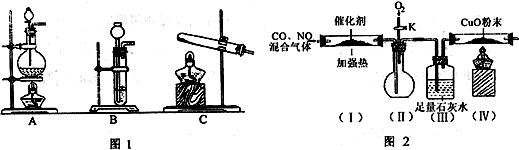
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。

(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下体积为 L(忽略气体溶解)。
科目:gzhx 来源:2014届福建省高一第一学期联合命题考试化学试卷 题型:填空题
(13分)化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示:

则:操作①的名称是 ,操作③使用的试剂(写化学式) 。操作② 中发生反应的离子方程式为 。
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
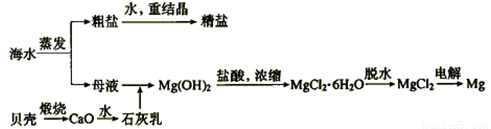
①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为 。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式 ( )NaCl+( )H2O
 ( )NaOH+H2↑+( )( )。
( )NaOH+H2↑+( )( )。
科目:gzhx 来源:2014届福建省三明市高一上学期联合命题考试化学试卷 题型:实验题
(13分)化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示:
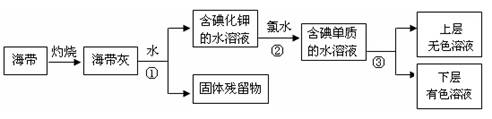
则:操作①的名称是 ,操作③使用的试剂(写化学式) 。操作② 中发生反应的离子方程式为 。
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:

①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为 。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式 ( )NaCl+( )H2O  ( )NaOH+H2↑+( )( )。
( )NaOH+H2↑+( )( )。
科目:gzhx 来源: 题型:阅读理解
(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
![]()
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下体积为 L(忽略气体溶解)。
科目:gzhx 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:058
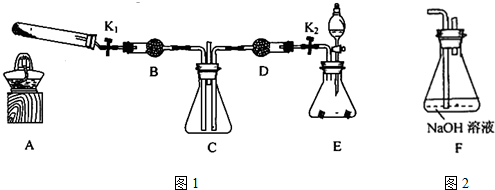
某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题.三名同学设计的制备实验方案的反应流程分别如下:
 请回答下列问题:
请回答下列问题:
(1)请指出甲.乙两方案的主要缺点:
甲方案______________.
乙方案______________.
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3.乙同学选择澄清石灰水测定其中NaHCO3的质量分数,请说明其计算所需的数据;若不能,请简要说明理由:
______________.
(3)若采用丙方案制取纯Na2CO3溶液,其实验的关键有________.
(4)按如下实验步骤具体实施丙方案
①用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解.
②小心煮沸溶液1 min-2 min.
③在得到的溶液中再加入25 mL NaOH溶液,使溶液充分混合.
请回答下列问题:
A.第①步实验装置如图,装置A中使用的试剂是石灰石和盐酸溶液.装置B使用的试剂是________,作用是________.
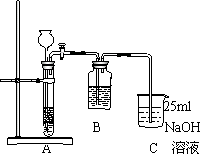
B.有人认为实验步骤②、③的顺序应对调,即先混合再煮沸更合理,你认为对吗?________.为什么?__________________________.
科目:gzhx 来源: 题型:
①称量CuSO4·5H2Om1g,在研钵中研细后,完全溶于适量水中;
②向盛硫酸铜溶液的烧杯内加入稍过量的NaOH溶液,使Cu2+完全沉淀;
③将烧杯内的悬浊液转移到蒸发皿中,小火加热至沸,搅拌,直到沉淀完全变为黑色;
④冷却后,过滤,并用蒸馏水洗涤沉淀2—3次;
⑤将固体充分干燥后,称量得CuO m2g,研细备用。
请回答:
(1)本实验多次用到玻璃棒,其作用分别为步骤①___________,步骤③___________,步骤④___________。
(2)步骤②中证明NaOH已足量的方法是_________________。
(3)步骤④中洗涤沉淀的操作为_________________,目的是___________________。
Ⅱ.该小组用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
2 NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
请回答:
(1)如果选用测定生成物Cu和H2O的质量m(Cu)、m(H2O)时,请用下列仪器设计一个简单的实验方案。
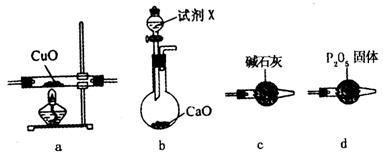
①仪器连接的顺序(用字母编号表示,仪器可重复使用)_____________;d的作用是___________;b中试剂X的名称是___________。
②列出计算Cu的相对原子质量的表达式___________。
(2)①如果仍采用上述仪器装置,测定下列物理量也可以达到实验目的的有___________。
A.m(CuO)和m(H2O) B.V(N2)和m(CuO)
C.m(NH3)和m(H2O) D.m(CuO)和m(Cu)
②若可以增加仪器装置,为达到实验目的,上述A、B、C、D还可以选择___________;完成此选择的实验,应该增加的仪器是___________(选择装置代号)。
科目:gzhx 来源: 题型:阅读理解
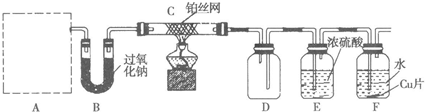
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
![]()

检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片 刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。
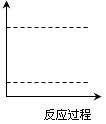
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下体积为 L(忽略气体溶解)。
科目:gzhx 来源:0125 模拟题 题型:计算题
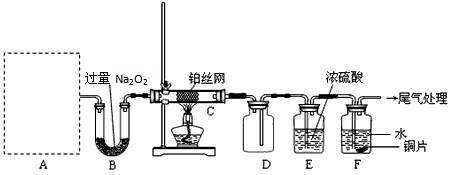

科目:gzhx 来源: 题型:阅读理解
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
![]()
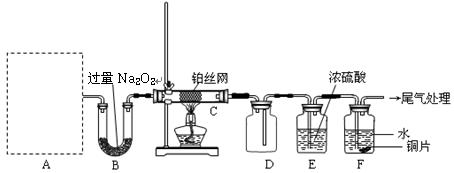
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中![]() Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下体积为 L(忽略气体溶解)。
科目:gzhx 来源: 题型:
某化学课外活动小组设计实验探究氮的化合物的性质,装置如图15所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
![]() a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
![]()
![]()
![]()
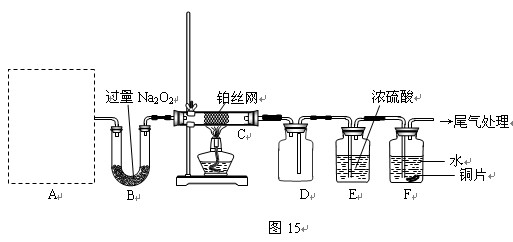
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
![]() (1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的是 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在图16坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol・L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下是 L(忽略气体溶解)。
科目:gzhx 来源: 题型:
(13分)化工生产必须遵循科学原理。请根据下列工艺生产流程回答问题。
(1)某化学课外活动小组以海带为原料获得少量碘,其过程如下图所示:
则:操作①的名称是 ,操作③使用的试剂(写化学式) 。操作② 中发生反应的离子方程式为 。
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
①上述流程中生成Mg(OH)2沉淀的离子方程式为 。Mg(OH)2沉淀和盐酸反应的离子方程式为 。
②实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
③工业上把电解饱和食盐水称为“氯碱工业”。请你完成电解饱和食盐水的化学方程式 ( )NaCl+( )H2O ( )NaOH+H2↑+( )( )。
科目:gzhx 来源: 题型:阅读理解
| ||
| 微热 |
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
科目:gzhx 来源: 题型:阅读理解