
科目:gzhx 来源:辽宁省东北育才学校高中部2008-2009学年高一下学期第一次月考化学试题 题型:021
|
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.下列说法正确的是
| |
A. |
Fe比Pb活泼,始终作负极 |
B. |
Fe在浓硝酸中钝化,始终不会溶解 |
C. |
电池停止工作时,烧杯中生成了硝酸铁 |
D. |
利用浓硝酸做电解质溶液不符合“绿色化学”思想 |
科目:gzhx 来源: 题型:阅读理解
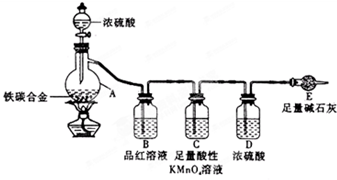 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.| △ |
| ||
| ||
| 3b |
| 11a |
| 3b |
| 11a |
科目:gzhx 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
科目:gzhx 来源: 题型:阅读理解
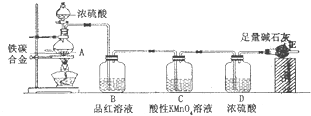 (2013•保定一模)某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测 定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应.请回答下列问题:
(2013•保定一模)某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测 定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应.请回答下列问题:| 3b |
| 11m |
| 3b |
| 11m |
科目:gzhx 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
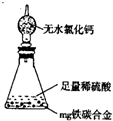
科目:gzhx 来源: 题型:阅读理解

| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
m-
| ||
| m |
m-
| ||
| m |
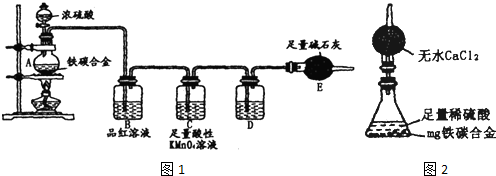
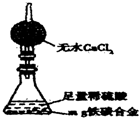 (5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是
(5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是科目:gzhx 来源:2014届安徽省高三上学期段一考试化学试卷(解析版) 题型:选择题
能说明Al的金属活动性比Cu强的事实是
A.以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解
B.与氯气反应时,铝失去3个电子,而铜失去2个电子
C.常温下,铝在浓硝酸中钝化而铜不发生钝化
D.常温下将铝和铜用导线连接放入到稀盐酸中,铝为负极
科目:gzhx 来源:2012-2013学年福建省协作校内部模拟卷理综化学试卷(解析版) 题型:实验题
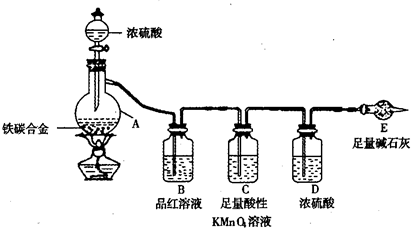
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。
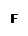
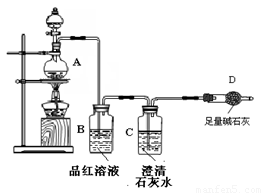
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
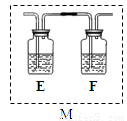
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)
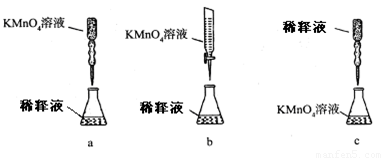
③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。
科目:gzhx 来源:甘肃省兰州一中2009届高三上学期第三次月考化学试题 题型:013
|
说明Al的金属活动性比Cu强的事实是 | |
| [ ] | |
A. |
以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解 |
B. |
与氯气反应时,铝失去3个电子,而铜失去2个电子 |
C. |
常温下,铝在浓硝酸中钝化而铜不发生钝化 |
D. |
常温下将铝与铜用导线连接放入到稀盐酸中,铝为负极 |
科目:gzhx 来源: 题型:
下列事实能说明Al的金属活动性比Cu强的是
A、常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中
B、常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中
C、与氯气反应时,铝失去3个电子,而铜失去2个电子
D、常温下,铝在浓硝酸中钝化而铜不发生钝化
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源:0103 月考题 题型:单选题
科目:gzhx 来源: 题型:
能说明Al的金属活动性比Cu强的事实是
A.以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解
B. 与氯气反应时,铝失去3个电子,而铜失去2个电子
C. 常温下,铝在浓硝酸中钝化而铜不发生钝化
D.常温下将铝和铜用导线连接放入到稀盐酸中,铝为负极
科目:gzhx 来源: 题型:
能说明Al的金属活动性比Cu强的事实是( )
A.以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解
B.与氯气反应时,铝失去3个电子,而铜失去2个电子
C.常温下,铝在浓硝酸中钝化而铜不发生钝化
D.常温下将铝和铜用导线连接放入到稀盐酸中,铝为负极
科目:gzhx 来源:2010年四川省绵阳市高三第三次诊断性考试(理综)化学部分 题型:填空题
(14分)用A~M分别代表一种物质,它们之间的转化关系如下图所示(部分生成物略去)。其中A为紫色晶体,B、H、J均为常见的单质气体,单质E在浓硝酸中钝化。
请回答下列问题:

(1)D的化学式是 ,L由3种元素组成,其电子式是 。
(2)E元素在周期表中的位置是 。工业上可利用C与E在高温下反应冶炼金属,该反应的化学方程式是 。
(3)用C与F溶液制H气体时,发生反应的化学方程式是 。
(4)用石墨电极电解D的水溶液时,阳极的电极反应式是 。
(5)在500 mL 0.2 mol/L K物质的水溶液中逐滴加入F的水溶液并不断搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随加入F的物质的量的变化曲线。

科目:gzhx 来源: 题型:
(14分)用A~M分别代表一种物质,它们之间的转化关系如下图所示(部分生成物略去)。其中A为紫色晶体,B、H、J均为常见的单质气体,单质E在浓硝酸中钝化。
请回答下列问题:
(1)D的化学式是 ,L由3种元素组成,其电子式是 。
(2)E元素在周期表中的位置是 。工业上可利用C与E在高温下反应冶炼金属,该反应的化学方程式是 。
(3)用C与F溶液制H气体时,发生反应的化学方程式是 。
(4)用石墨电极电解D的水溶液时,阳极的电极反应式是 。
(5)在500 mL 0.2 mol/L K物质的水溶液中逐滴加入F的水溶液并不断搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随加入F的物质的量的变化曲线。
科目:gzhx 来源:导学大课堂必修一化学人教版 人教版 题型:043
如果在室温时试验铁片在硝酸中的反应速率与硝酸浓度的关系,我们将会发现铁的反应速率最初是随硝酸浓度的增大而增大.当增大到一定程度时,它的反应速率迅速减小,继续增大硝酸的浓度时,它的反应速率更小,最后不再起反应,即铁变得“稳定”了.
这种现象叫金属的“钝化”,是由于浓硝酸具有强氧化性,在铁的表面氧化生成了一层致密的氧化物薄膜,隔离了内部的金属与浓硝酸的接触,使反应自动终止.
不仅铁,其他一些金属也可以发生钝化.例如,Cr、Ni、Co、Mo、Al、Ta、Nb和W等,其中最容易钝化的金属是Cr、Mo、Al、Ni、Fe.
不仅硝酸,其他强氧化剂如浓硫酸、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以引起金属的钝化.
在个别情况下,少数钨能在非氧化剂介质中钝化.例如,镁在HF中钝化,钼和铌在HCl中钝化.
一般的说,钝化后的金属,在改变外界钝化条件后,仍能在相当程度上保持钝化状态.例如,铁在浓硝酸中钝化后,不仅在稀硝酸中保持稳定,而且在水、水蒸气及其他介质中也能保持稳定.钝化后的铁不能从硝酸铜溶液中置换出铜.
使金属钝化的方法,除了把金属浸在浓酸里使它钝化外,还可以把金属作为电极(阳极),通过电流使它发生氧化.当电流密度增大到一定程度时,金属就能被钝化.
问题:金属的钝化,使之变得“稳定”,那么能不能破坏这种钝化状态呢?
科目:gzhx 来源: 题型:
用A~M分别代表一种物质,它们之间的转化关系如下图所示(部分生成物略去)。其中A为紫色晶体,B、H、J均为常见的单质气体,单质E在浓硝酸中钝化。
请回答下列问题:

(1)D的化学式是 ,L由3种元素组成,其电子式是 。
(2)E元素在周期表中的位置是 。工业上可利用C与E在高温下反应冶炼金属,该反应的化学方程式是 。
(3)用C与F溶液制H气体时,发生反应的化学方程式是 。
(4)用石墨电极电解D的水溶液时,阳极的电极反应式是 。
(5)在500 mL 0.2 mol/L K物质的水溶液中逐滴加入F的水溶液并不断搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随加入F的物质的量的变化曲线。

科目:gzhx 来源: 题型:
 某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
|
科目:gzhx 来源: 题型:022
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
甲 乙 丙 丁
化合物中
各元素原子
个数比 A∶C=1∶1 B∶A=1∶4 D∶E=1∶3 B∶E=1∶4
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素?推断依据是什么?
_________________________________________。
_________________________________________。
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是什么?
_________________________________________。
_________________________________________。
(3)向甲的水溶液中加入MnO2,反应的化学方程式
_____________________________________________________________________________。
(4)乙可以燃烧,燃烧时火焰呈蓝色,试写出乙燃烧的化学方程式
_____________________________________________________________________________。(5)D形成的单质在浓硫酸中钝化,而在盐酸中反应生成丙,试解释D在浓硫酸中钝化的原因:
_______________________________________________________________________________
_____________________________________________________________________________。
写出D与盐酸反应生成丙的反应式:
_____________________________________________________________________________。
(6)向3mL1mol×L-1的KI溶液中依次注入下列试剂:①1mL5mol×L-1的盐酸;②0.5mL 30%甲溶液;③1mL丁,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是什么___________________________________________________________________________________。