
科目:gzhx 来源: 题型:阅读理解
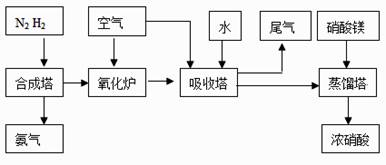
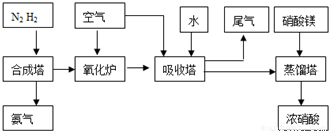
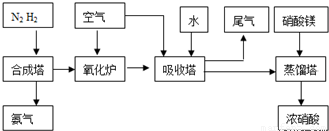
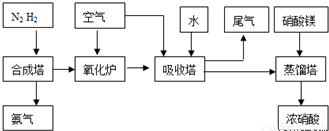
 (2009•中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009•中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: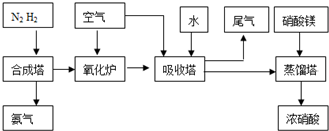
| 时间(h)浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
| 1 |
| a |
| 1 |
| a |
科目:gzhx 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如下:
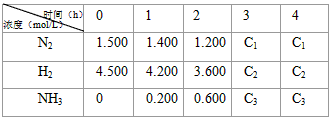
(1)某温度下体积为200L的氨合成塔中,测得如下数据:
| 0 | 1 | 2 | 3 | 4 |
N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
根据表中数据计算0~2小时内N2的平均反应速率 mol・L-1・h-1
若起始时与平衡时的压强之比为a,则N2的转化率为 (用含a的代数式表示)
(2)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式
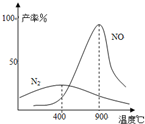
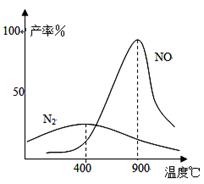
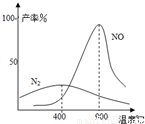
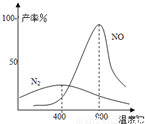
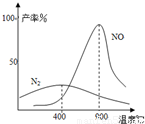
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如右图):
 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2![]() 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
![]() 温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。吸收塔中需要补充空气的原因 。
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。吸收塔中需要补充空气的原因 。
![]() (4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2 和N2请写出有关反应化学方程式 , 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2 和N2请写出有关反应化学方程式 , 。
科目:gzhx 来源:2009年广东省中山市高考化学模拟试卷(解析版) 题型:填空题
| 时间(h)浓度(mol/L) | 1 | 2 | 3 | 4 | |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0.200 | 0.600 | C3 | C3 |
科目:gzhx 来源:2011年江苏省徐州市睢宁县菁华学校高考化学一模试卷(解析版) 题型:填空题
| 时间(h)浓度(mol/L) | 1 | 2 | 3 | 4 | |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0.200 | 0.600 | C3 | C3 |
科目:gzhx 来源:2009年江苏省南通市通州区平潮高级中学高考化学模拟试卷(五)(解析版) 题型:填空题
| 时间(h)浓度(mol/L) | 1 | 2 | 3 | 4 | |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0.200 | 0.600 | C3 | C3 |
科目:gzhx 来源:0119 竞赛题 题型:填空题
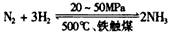 △H <0,生产流程如图所示。
△H <0,生产流程如图所示。 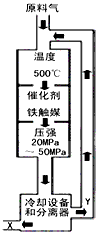
 N2(g)+3H2(g)的平衡常数______________。
N2(g)+3H2(g)的平衡常数______________。科目:gzhx 来源:2015届福建省福州市八县高二上学期期末考试化学试卷(解析版) 题型:填空题
制取尿素 [CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
|
物质的量mol |
0min |
2 min |
3 min |
4 min |
|
NH3 |
2.0 |
1.4 |
n1 |
n1 |
|
CO2 |
1.0 |
0.7 |
n2 |
n2 |
|
H2O |
0 |
0.3 |
n3[ |
n3 |
(1)根据表中数据计算0~2min内NH3的平均反应速率 ,若起始时与平衡时的气体总压强之比为15/11,n1= mol。
(2)该温度下此反应的平衡常数表达式为
(3)下列各项能表示该反应达到平衡状态是 。
A.消耗NH3的物质的量与生成H2O的物质的量之比为2∶1
B.c(NH3):c(CO2):c(H2O)=2∶1∶1
C.气体密度不再变化
D.容器压强不再变化
科目:gzhx 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:填空题
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
|
|
0 min |
l min |
2 min |
3 min |
4 min |
|
N2 |
1.500 |
1.400 |
1.200 |
c1 |
c1 |
|
H2 |
4.500 |
4.200 |
3.600 |
c2 |
c2 |
|
NH3 |
0 |
0.200 |
0.600 |
c3 |
c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
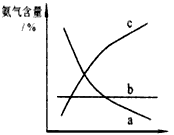
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。

A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
科目:gzhx 来源: 题型:
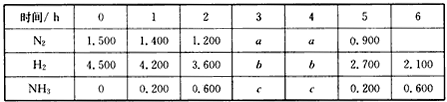
(1)某温度下体积为100 L的氨合成塔中(已知合成氨的反应为放热反应),测得各物质浓度(mol/L)的变化如下表:根据表中数据计算0 h~2 h内N2的平均反应速率 为 。请用下表中适当的数据表示该反应的平衡常数表达式: 。
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| N2 | 1.500 | 1.400 | 1.200 | a | a | 0.900 | |
| H2 | 4.500 | 4.200 | 3.600 | b | b | 2.700 | 2.100 |
| NH3 | 0 | 0.200 | 0.600 | c | c | 0.200 | 0.600 |
(2)反应在4 h~5 h之间,平衡向正方向移动,可能的原因是
(选填A~F,下同)表中5h~6h之间数值发生变化,可能的原因是 。
A.移走了氨气 B.降低温度 C.加压
D.增加氢气浓度 E.升高温度 F.增加氮气浓度
(3)将NH3通入到0.04 mol·L-1的FeCl3溶液中,要使溶液中Fe3+
沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为
(已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
科目:gzhx 来源:河南省模拟题 题型:填空题
科目:gzhx 来源: 题型:
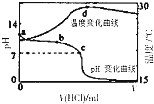 某温度下,NH3?H2O的电离常数为1.6×10-5,将1.000mol?L-1的盐酸逐滴滴入20.00mL 1.000mol?L-1氨水中,溶液的pH和温度随加入盐酸体积变化曲线如图所示,下列有关说法不正确的是( )
某温度下,NH3?H2O的电离常数为1.6×10-5,将1.000mol?L-1的盐酸逐滴滴入20.00mL 1.000mol?L-1氨水中,溶液的pH和温度随加入盐酸体积变化曲线如图所示,下列有关说法不正确的是( )| A、a点:溶液的pH约为12.6 | B、b点:c(NH 4+)>c(Cl-)>c(OH-)>c(H+) | C、c点:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
科目:gzhx 来源: 题型:阅读理解
瑞典皇家科学院2007年10月10日宣布,将本年度诺贝尔化学奖授予德国马普学会弗里茨一哈勃研究所的格哈德・埃特尔教授,以表彰他在固体表面化学过程研究领域做出开拓性成就。格哈德・埃特尔的重要贡献之一是对哈伯一博施法合氨反应催化机理的研究。格哈德・埃特尔建立的某温度下合成氨反应机理的各步反应的能量变化如图所示,图中的能量单位为kJ・mol-1。(注:图中“吸表示在催化剂表面的吸附)
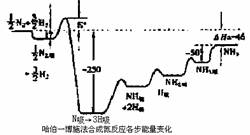
请回答下列问题:
(1)在合成氨反应中,决定反应速率的最主要的步骤是 (填字母)
A.氮分子解离为氢原子
B.氮原子的解离吸附
C.氢分子解离为氢原子
D.氨的解离吸附
(2)合成氨反应的机理为(用化学方程式表示)
① ;
②N2 ![]() N2吸
N2吸 ![]() 2N吸;
2N吸;
③ ;
④NH吸+H吸 ![]() NH3吸
NH3吸
⑤NH2吸+H吸![]() NH3吸
NH3吸 ![]() NH3
NH3
(3)某温度下合成氨反应的热化学方程式为 ;
(4)某温度下,合成氨反应Ke=3.0×103(mol・L-1)-2,该温度下,在体积恒定为10L的四个密闭容器中分别充入;(A)10mol、30mol H2和20molNH3(B)10molN2和30molH2(C)20molN2和60molH2(D)10molN2和28molH2(E)0.1molN2、0.3molH2和20MolNH3,则反应达到平衡后,N2的转化率最大的是 (填字母)。
(5)合成氨工业生产中所用的α―Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe3+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉。发生如下反应:2Fe2O3+C=4FeO+CO2,为制得该种活性最高的催化剂,应向480gFe2O3粉末加入炭粉的质量为 g.
科目:gzhx 来源:广东省期末题 题型:填空题
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol 测得CO2和
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 测得CO2和
 2NH3(g) △H=-92 kJ·mol-1。
2NH3(g) △H=-92 kJ·mol-1。
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
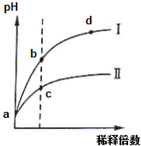 某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )
某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )| A、Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线 | B、b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同 | C、a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同 | D、c点溶液的导电能力一定比b点溶液导电能力强 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
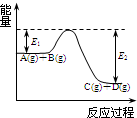 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题:科目:gzhx 来源: 题型:
 9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2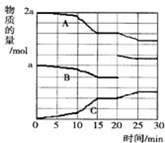 (4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是
(4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是科目:gzhx 来源: 题型:阅读理解
| 1 |
| 2.25 |
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |