
科目:czhx 来源: 题型:
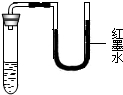
 15、将等质量的NaCl、KNO3、NH4NO3、NaOH等4种固体放入试管中,再加入等质量的水,盖好橡胶塞,振荡、静置,观察到的现象如图所示.则试管中加入的固体是
15、将等质量的NaCl、KNO3、NH4NO3、NaOH等4种固体放入试管中,再加入等质量的水,盖好橡胶塞,振荡、静置,观察到的现象如图所示.则试管中加入的固体是科目:czhx 来源: 题型:阅读理解
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ① | 1.2g | ||
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
科目:czhx 来源: 题型:
 将等质量的甲、乙两种固体放入试管中,加入等量的水,充分溶解,放入20℃的水中,观察到如图一所示现象,将烧杯中的水升温至30℃,充分溶解后,观察到现象如图二所示.
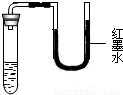
将等质量的甲、乙两种固体放入试管中,加入等量的水,充分溶解,放入20℃的水中,观察到如图一所示现象,将烧杯中的水升温至30℃,充分溶解后,观察到现象如图二所示.科目:czhx 来源:新人教版九年级下册《第9章 溶液》2013年单元检测训练卷D(一)(解析版) 题型:解答题
科目:czhx 来源:《10.3 溶质的质量分数》2010年双基落实A卷(解析版) 题型:解答题
科目:czhx 来源: 题型:填空题
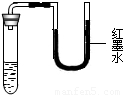
 将等质量的NaCl、KNO3、NH4NO3、NaOH等4种固体放入试管中,再加入等质量的水,盖好橡胶塞,振荡、静置,观察到的现象如图所示.则试管中加入的固体是________,理由是________.
将等质量的NaCl、KNO3、NH4NO3、NaOH等4种固体放入试管中,再加入等质量的水,盖好橡胶塞,振荡、静置,观察到的现象如图所示.则试管中加入的固体是________,理由是________.科目:czhx 来源:不详 题型:填空题

科目:czhx 来源: 题型:阅读理解
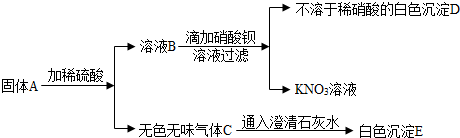
某化学兴趣小组的同学阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他们对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
 (1)上述实验应测量的“待测数据”是 。
(1)上述实验应测量的“待测数据”是 。
(2)若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
【结论】氧化铜能加快氯酸钾的分解速率,所以氧化铜能作为氯酸钾分解的催化剂。
【讨论反思】小芳认为仅凭上述的实验还不能证明氧化铜为氯酸钾的催化剂,她觉得要增加一个实验:探究 。
【实验步骤】将实验②反应后的固体加水溶解、过滤、洗涤、干燥、称量,测得固体质量为0.5g。
【分析】小华认为,要证明氧化铜是氯酸钾的催化剂,小芳的补充实验还不够,需要再补充一个实验:探究 。
【实验步骤】取上述实验所得的0.5 g固体放入试管中, (简述操作和现象)。
g固体放入试管中, (简述操作和现象)。
【结论】氧化铜也能作氯酸钾分解的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是  。
。
科目:czhx 来源:2012-2013学年江苏省连云港市东海县张湾中学九年级(下)段考化学试卷(解析版) 题型:解答题
科目:czhx 来源:新课标教材典型例题详解 九年级化学 全 题型:022
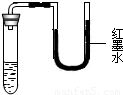
将等质量的
NaCl、KNO3、NH4NO3、NaOH等4种固体放入试管中,再加入等质量的水,盖好橡胶塞,振荡、静置,观察到的现象如下图所示.则试管中加入的固体是________,理由是________.
科目:czhx 来源: 题型:
将等质量的甲、乙两种固体放入试管中,加入等量的水,充分溶解,放入20℃的水中,观察到如下图一所示现象,将烧杯中的水升温至30℃,充分溶解后,观察到现象如下图二所示。
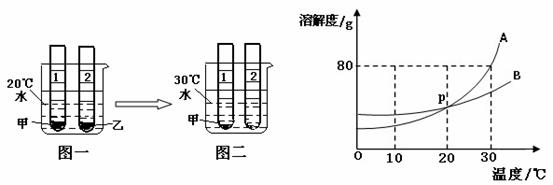
(1)图二两支试管中的溶液一定是饱和溶液的试管编号为 ;
(2)如果上图右边溶解度曲线表示A、B两种固体的溶解度曲线,若A、B分别对应甲、乙两种固体中的一种,则B对应的物质是 ;
(3)30℃时80gA加入50g水中充分溶解,所得溶液的质量为 g;
(4)将30℃A、B两种物质的饱和溶液各100g,分别降温至10℃时所得溶液的溶质质量分数较大的溶液的溶质是 。
科目:czhx 来源: 题型:阅读理解
 16、人的胃液里含有适量的盐酸,可以帮助消化,
16、人的胃液里含有适量的盐酸,可以帮助消化,科目:czhx 来源: 题型:
| 步骤 | 现象和结论 | |
| 方案一 | 取少量A固体放入试管中,并塞上带导管的橡皮塞,将导管伸入石灰水中,给试管加热. | 若观察到试管壁有 |
| 方案二 | |
科目:czhx 来源: 题型:
 16、氢氧化铜固体受热分解能得到两种产物,其中一种为固定.某学生小组为确定这种固体产物是什么,进行了如下探究活动.
16、氢氧化铜固体受热分解能得到两种产物,其中一种为固定.某学生小组为确定这种固体产物是什么,进行了如下探究活动.| 实验步骤 | 可能出现的实验现象 | 实验结论 |
取少量黑色粉末放入试管中,加入足量稀硫酸 |
黑色粉末逐渐消失,溶液变成蓝色 |
黑色粉末是氧化铜 |
科目:czhx 来源: 题型:阅读理解
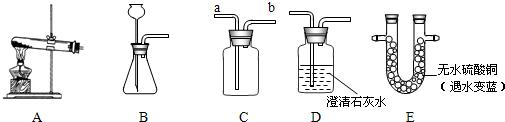
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:将一定量绿色固体装入反应容器中,进行实验 | ①白色无水硫酸铜变蓝色 ②___________________ ③绿色固体变黑色 | 产物中有___________________ 产物中有二氧化碳 写出检验二氧化碳的化学方程式: ____________________________ |
| 实验Ⅱ:取反应后的黑色固体放入试管中,加入足量的稀硫酸 | 黑色固体完全溶解,溶液变蓝色 | 黑色固体是氧化铜 反应的化学方程式: ____________________________ |
科目:czhx 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中加水溶解,滴入适量的澄清石灰水 | 产生白色沉淀 | 猜想一正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变红 |
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中加水溶解,滴入足量的 氯化钙溶液 氯化钙溶液 . |
产生白色沉淀 | 猜想一正确 |
| 取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变红 |

科目:czhx 来源: 题型:
科目:czhx 来源: 题型:阅读理解

| 实验现象 | 结论 |
| (1) (2) |
| 实验步骤 | 实验现象 | 结论 |
| 待实验一完成后,将试管中的残余物小心过滤,并将全部滤渣洗涤、干燥、称量,观察是否仍为ag | 称重氧化铁的质量为ag |
| 实验步骤 | 实验现象 | 结论 |
| 将实验二的滤渣重新放入试管中,再加入少量过氧化氢溶液,并插入带火星木条,如此反复多次实验,观察现象 | 带火星木条复燃 |
| ||
| ||
科目:czhx 来源: 题型:
科目:czhx 来源: 题型: