
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:阅读理解
| 10-7y |
| x-y |
| 10-7y |
| x-y |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| 阳离子 | Na+、Mg2+、Fe3+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO32-、OH-、CO32-、SO42- |
科目:gzhx 来源: 题型:
| 催化剂 | △ |
科目:gzhx 来源: 题型:
科目:gzhx 来源:2011-2012学年四川省雅安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
2分)25℃,已知pH = 2的高碘酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;pH = 2的高锰酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。将可溶性的高碘酸钡[Ba5(IO6)2]与稀硫酸混合,发生反应的离子方程式为:____________。
科目:gzhx 来源:2013-2014学年湖南省长沙市高三第四次月考化学试卷(解析版) 题型:填空题
25℃时,电离平衡常数:
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
H2C4H4O 6(酒石酸) |
H2SO3 |
|
电离平衡常数 |
2.0×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
K1=9.1×10-4 K2=4.3×10-5 |
K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH= (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) = c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)= c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)= c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
科目:gzhx 来源:2012-2013学年上海市青浦区高考一模化学试卷(解析版) 题型:填空题
氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
1、(1)配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
(2)若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
2、已知:4NH3+O2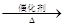 4NO+6NO,4NO+3O2+2H2O
4NO+6NO,4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
(1)a mol NO完全转化为HNO3理论上需要氧气_____________mol。
(2)为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________ (保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
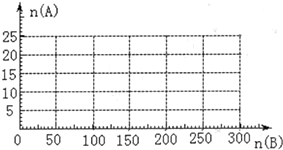
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
科目:gzhx 来源:2012-2013学年广东省惠州市高三第三次调研考试理综化学试卷(解析版) 题型:填空题
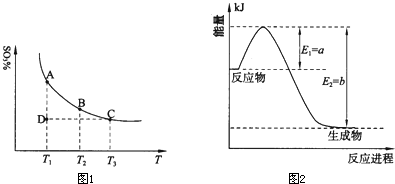
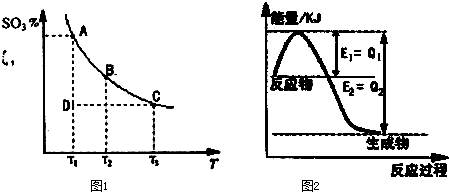
运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义。
(1)在反应:2SO2(g)+O2(g) 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):

①2SO2(g)+O2(g) 2SO3(g)的△H
0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将
移动(填“向左”、“向右”或“不”);
2SO3(g)的△H
0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将
移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正 V逆(填“>”、“<”或“=”)。
(2)①下图是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式 。(△H用含Q1、Q2的代数式表示)

②25°C时,将a mol • L―1的氨水与b mol • L―1的盐酸等体积混合,所得溶液的pH=7,则c (NH4+) c(Cl―),a b(填“>”、“<”或“=”);
(3)海水中含有大量以化合态形式存在的氯、碘元素。已知:250C时,Ksp(AgCl)=1.6×10―10mol2•L―2、Ksp(AgI)=1.5×10―16mol2•L―2。
在 250C时,向 10mL0.002mol•L―1 的 NaCl 溶液中滴入 10mL0.002mol•L―1AgNO3溶液, 有白色沉淀生成,向所得浊液中继续滴人0.1mol •L―1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是 ,该反应的离子方程式 。
科目:gzhx 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
科目:gzhx 来源: 题型:022
将质量分数分别为25%的氨水与5%的氨水等质量混合后,所得氨水的量分数为_________;若将上述两溶液等体积混合,所得氨水的质量分数____________15%(填“大于”“小于”或“等于”).
科目:gzhx 来源:2011年浙江省杭州市萧山区高考化学模拟试卷(十六)(解析版) 题型:解答题

科目:gzhx 来源: 题型:解答题
 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
科目:gzhx 来源:读想用 高二化学(上) 题型:022
将质量分数分别为25%氨水与5%氨水等质量混合后,所得氨水的质量分数为________;若将上述两溶液等体积混合,所得氨水的质量分数________15%(填“大于”“小于”或“等于”).
科目:gzhx 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
将质量分数分别为25%氨水与5%氨水等质量混合后,所得氨水的质量分数为________;若将上述两溶液等体积混合,所得氨水的质量分数________15%(填“>”“<”或“=”).
科目:gzhx 来源:2012-2013学年上海市青浦区高三(上)期末暨高考化学一模试卷(解析版) 题型:解答题
 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
科目:gzhx 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:022
(1)把90%的H2SO4溶液与10%的H2SO4溶液等体积混合后所得溶液的质量分数________(填“大于”、“等于”、“小于”)50%.若将90%的H2SO4按1∶4稀释,则稀释后溶液的质量分数的取值范围为________.
(2)将25%的氨水与5%的氨水等体积混合后,所得溶液的质量分数________(填“大于”、“等于”、“小于”)15%;若混合后质量分数等于10%,则两者体积比应________.