
科目:gzhx 来源: 题型:
电解100mL 16%的氢氧化钠溶液(密度为1g/cm3),用石墨作电极,10min后电解液的浓度为19.5%,这是因为( )
A.溶质增加了3.5g
B.氢氧化钠的物质的量不变,而水被电解了1mol
C.氢氧化钠的消耗比水的消耗少
D.氢氧化钠不参加反应,只有水参加反应,且放出H2和O2,消耗了18g水
科目:gzhx 来源:2013届江西省高二第二次月考化学试卷 题型:填空题
(9分)某研究性学习小组将下列装置如图连接,a、b、c、d、g、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
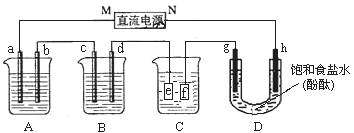
试回答下列问题:
(1)电源M极的名称是______。
(2)通电一段时间,取出电极,向A中加入4.9gCu(OH)2,溶液与电解前相同,则电解时电路中通过的电子为_________mol,原CuSO4溶液物质的量浓度为________mol•L-1;
(3)B中d的电极反应式为________________________________________________,
d极上产生的气体体积为____________L(标况)
(4)欲用C装置给铜镀银,f是__________(填银或铜),电镀液是__________溶液。
(5)电解后将D中溶液倒入烧杯,稀释至200ml,此时溶液的PH=_______。
科目:gzhx 来源: 题型:
A.溶质增加了3.5 g B.有1 mol NaOH被电解
C.在阳极生成2 g H2 D.在阳极生成16 g O2
科目:gzhx 来源:2012-2013学年河北省高考复习综合测试化学试卷(解析版) 题型:选择题
电解84.7mL、质量分数为16%的氢氧化钠溶液(密度1.18g·cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨作电极),这是因为( )
(A)溶质增加了3.5g (B)有1mol水被电解
(C)在阳极生成2gH2 (D)在阳极生成16gO2
科目:gzhx 来源:黄冈重点作业 高一化学(下) 题型:038
接触法制硫酸排放的尾气中,含少量的二氧化硫.为防止污染大气,在排放前设法进行综合利用.
(1)某硫酸厂每天排放的1万 尾气中含0.2%(体积分数)的
尾气中含0.2%(体积分数)的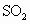 .用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(
.用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(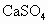 ·2
·2 )?
)?
(2)如果将一定体积的尾气通入100ml 2mol· 的氢氧化钠溶液中使其完全反应,经测定所得溶液含16.7g溶质.试分析该溶液的成分,并计算确定各成分的物质的量.
的氢氧化钠溶液中使其完全反应,经测定所得溶液含16.7g溶质.试分析该溶液的成分,并计算确定各成分的物质的量.
(3)某工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠.调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量.现设n(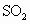 ),n(NaOH),
),n(NaOH), 分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且
分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且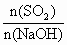 =x,试写出x在不同取值范围时,
=x,试写出x在不同取值范围时, 与n(
与n(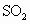 )、n(NaOH)间的关系式.
)、n(NaOH)间的关系式.
科目:gzhx 来源:高一化学(通用各科奥林匹克ABC卷及解析) 题型:043
接触法制硫酸排放的尾气中,含少量的二氧化碳.为防止污染大气,在排放前设法进行综合利用.
(1)某硫酸厂每天排放的1万![]() (标准状况下测定)尾气中含0.2%(体积分数)的
(标准状况下测定)尾气中含0.2%(体积分数)的![]() .问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少kg石膏(
.问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少kg石膏(![]() ).
).
(2)如果将一定体积的尾气通入100mL 2![]() 的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质.试分析该溶液的成份,并计算确定各成份的物质的量.
的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质.试分析该溶液的成份,并计算确定各成份的物质的量.
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠,调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量
的最佳比值,从而提高亚硫酸氢钠的产量.现设n![]() 、nNaOH、n
、nNaOH、n![]() 分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且
分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且![]() =X,试写出X在不同取值范围时,n(
=X,试写出X在不同取值范围时,n(![]() )的值或n(
)的值或n(![]() )与n(
)与n(![]() )、n(NaOH)间的关系式.
)、n(NaOH)间的关系式.

科目:gzhx 来源:2012-2013学年河北省定州中学高考复习综合测试化学试卷(带解析) 题型:单选题
电解84.7mL、质量分数为16%的氢氧化钠溶液(密度1.18g·cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨作电极),这是因为( )
| A.溶质增加了3.5g | B.有1mol水被电解 |
| C.在阳极生成2gH2 | D.在阳极生成16gO2 |
科目:gzhx 来源: 题型:
A.溶质增加了3.5 g
B.有1 mol水被电解
C.在阳极生成了2 g H2
D.在阳极生成了16 g O2
科目:gzhx 来源: 题型:多选题
科目:gzhx 来源: 题型:
(9分)某研究性学习小组将下列装置如图连接,a、b、c、d、g、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
试回答下列问题:
(1)电源M极的名称是______。
(2)通电一段时间,取出电极,向A中加入4.9gCu(OH)2,溶液与电解前相同,则电解时电路中通过的电子为_________mol,原CuSO4溶液物质的量浓度为________mol•L-1;
(3)B中d的电极反应式为________________________________________________,
d极上产生的气体体积为____________L(标况)
(4)欲用C装置给铜镀银,f是__________(填银或铜),电镀液是__________溶液。
(5)电解后将D中溶液倒入烧杯,稀释至200ml,此时溶液的PH=_______。
科目:gzhx 来源:专项题 题型:单选题
科目:gzhx 来源:2011-2012学年江西省南昌二中高二第二次月考化学试卷 题型:填空题
(9分)某研究性学习小组将下列装置如图连接,a、b、c、d、g 、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
试回答下列问题:
(1)电源M极的名称是______。
(2)通电一段时间,取出电极,向A中加入4.9gCu(OH)2,溶液与电解前相同,则电解时电路中通过的电子为_________mol,原CuSO4溶液物质的量浓度为________mol•L-1;
(3)B中d的电极反应式为________________________________________________,
d极上产生的气体体积为____________L(标况)
(4)欲用C装置给铜镀银,f是__________(填银或铜),电镀液是__________溶液。
(5)电解后将D中溶液倒入烧杯,稀释至200ml,此时溶液的PH=_______。
科目:gzhx 来源: 题型:

科目:gzhx 来源:09-10年扬州中学高一下学期期末考试化学卷 题型:填空题
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)

⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。

⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
科目:gzhx 来源: 题型:
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
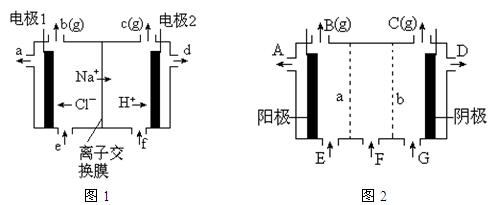
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO![]() 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO![]() ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
科目:gzhx 来源:2010-2011学年浙江省高三11月月考化学试卷 题型:填空题
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
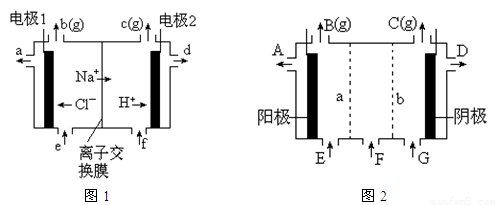
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
科目:gzhx 来源: 题型:
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)
⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
科目:gzhx 来源:2011-2012学年黑龙江庆安县第三中学高三上学期第一次月考化学试卷 题型:选择题
以铁为阳极,铜为阴极电解足量的氢氧化钠溶液。当生成2mol氢氧化铁沉淀时共消耗的水的物质的量为
A.2 mol B.3 mol C.4 mol D.5mol
科目:gzhx 来源:2011届浙江省杭州外国语学校高三11月月考化学试卷 题型:填空题
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。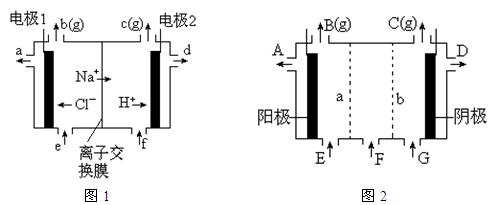
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO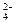 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO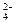 ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
科目:gzhx 来源:2014届云南玉溪一中高三上学期期中考试理综化学试卷(解析版) 题型:填空题
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。

(1)这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(2)写出在电解过程中发生的电极方程式阳极: 。
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中发生的电极方程式
阴极: 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。