
科目:gzhx 来源:2010年高考化学试题分项专题三物质的量 题型:选择题
在相同条件下,下列说法错误的是
A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度
B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高 的利用率
的利用率
科目:gzhx 来源:2010年普通高等学校招生统一考试理综试题化学部分(全国卷II) 题型:选择题
在相同条件下,下列说法错误的是
A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度
B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高 的利用率
的利用率
科目:gzhx 来源: 题型:
在相同条件下,下列说法错误的是
A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度
B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高![]() 的利用率
的利用率
科目:gzhx 来源:高考真题 题型:单选题
科目:gzhx 来源: 题型:
在相同条件下,下列说法错误的是
A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度
B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高![]() 的利用率
的利用率
科目:gzhx 来源:2010年普通高等学校招生统一考试理综试题化学部分(全国卷II) 题型:单选题
在相同条件下,下列说法错误的是
| A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度 |
| B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度 |
| C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度 |
D.工业上生产硫酸的过程中使用过量的空气可提高 的利用率 的利用率 |
科目:gzhx 来源: 题型:
在相同条件下,下列说法错误的是
A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度
B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高![]() 的利用率
的利用率
科目:gzhx 来源: 题型:
下列叙述正确的是 ( )
A.碘在碘化钾溶液中溶解度显著增大,原因是发生氧化还原反应生成I3-
B.氯化铁溶液遇KSCN溶液显红色,原因是生成Fe(SCN)3沉淀
C.氢氟酸需保存在塑料瓶中,原因是氢氟酸具有强酸性而腐蚀玻璃
D.氯化银难溶于水而溶于氨水,原因是生成Ag(NH3)2Cl溶液
科目:gzhx 来源: 题型:
下列叙述正确的是( )
A.碘在碘化钾溶液中溶解度显著增大,原因是发生氧化还原反应生成I3-
B.氯化铁溶液遇KSCN溶液显红色,原因是生成Fe(SCN)3沉淀
C.氢氟酸需保存在塑料瓶中,原因是氢氟酸具有强酸性而腐蚀玻璃
D.氯化银难溶于水而溶于氨水,原因是生成Ag(NH3)2Cl溶液
科目:gzhx 来源: 题型:
在相同条件下,下列说法错误的是
A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度
B.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高![]() 的利用率
的利用率
科目:gzhx 来源: 题型:
| A、③④①⑥②⑦⑤ | B、③⑤④①⑦②⑥ | C、③④⑦①②⑥⑤ | D、③④①⑦②⑥⑤ |
科目:gzhx 来源: 题型:阅读理解
| cV1-cV2 |
| 40 |
| cV1-cV2 |
| 40 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
科目:gzhx 来源: 题型:阅读理解
| 127bc×10-3 |
| 6a |
| 127bc×10-3 |
| 6a |
c
| ||
| c(I2)•c2(I-) |
c
| ||
| c(I2)•c2(I-) |
| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
科目:gzhx 来源:2011-2012学年山东省高三上学期第二次定时练习化学试卷1 题型:实验题
(10分)碘在工农业生产和日常生活中有重要用途。
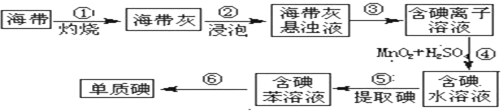
(1)右图为海带制碘的流程图。
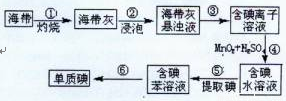
步骤③和⑤的实验操作名称分别是 、 ;
步骤④中发生反应的离子方程式为 ;
若步骤⑤采用四氯化碳来提取碘,将四氯化碳加入含碘水溶液中并振荡,观察到的现象是 。
(2)把滤纸用淀粉和碘化钾溶液浸泡,晾干后就是实验室常用的淀粉碘化钾试纸。利用淀粉碘化钾试纸可检验具有某种特性的气体。你认为淀粉碘化钾试纸用于检验具有 的气体(填序号)
A.酸性 B.碱性 C.氧化性 D.还原性
理由是 。
科目:gzhx 来源:2011-2012学年北京四中高一上学期期中考试化学试卷 题型:填空题
(9分)下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |