
科目:gzhx 来源: 题型:
2- 4 |
科目:gzhx 来源: 题型:
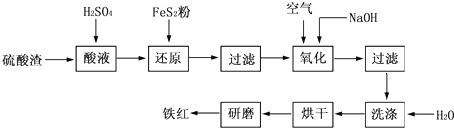
 (2011•镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
(2011•镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
| Mg(OH)2 | 8.0 | 12.4 |
科目:gzhx 来源: 题型:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀p H | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 11 |
| 4 |
| ||
| 1 |
| 2 |
| 11 |
| 4 |
| ||
| 1 |
| 2 |
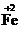 和
和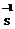
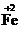 和
和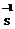
科目:gzhx 来源:2013-2014学年广东省等六校高三第三次联考理综化学试卷(解析版) 题型:填空题
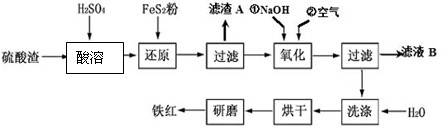
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
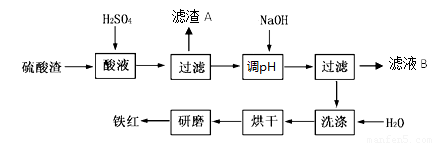
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
|
完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有______________________;
(4)简述洗涤过程的实验操作 ;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(已知相对原子质量:O 16 S 32 Fe 56 )
科目:gzhx 来源:广东省模拟题 题型:填空题
科目:gzhx 来源:江苏省无锡市2010年高三教学情况调查(一) 题型:填空题
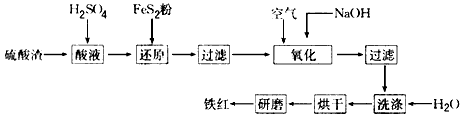
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是 。
(2)还原过程中加入FeS2是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为SO42—,写出
有关的离子方程式: 。
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式: 。
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH至3~4,其目的是 。
科目:gzhx 来源: 题型:解答题
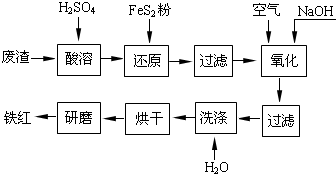 以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
| Mg(OH)2 | 8.0 | 12.4 |
科目:gzhx 来源: 题型:
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3)的过程如下:
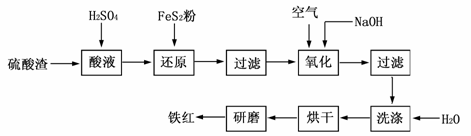
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是 。
(2)还原过程中加入FeS2是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为SO42—,写出
有关的离子方程式: 。
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式: 。
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH至3~4,其目的是 。
科目:gzhx 来源: 题型:解答题

 ,写出有关的离子方程式:______.
,写出有关的离子方程式:______.科目:gzhx 来源:2011年福建省泉州市晋江市季延中学高考化学模拟试卷(八)(解析版) 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀p H | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
 Fe2O3(s)+2SO2(g);△H=-798.75kJ/mol
Fe2O3(s)+2SO2(g);△H=-798.75kJ/mol 科目:gzhx 来源:镇江一模 题型:问答题
| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
| Mg(OH)2 | 8.0 | 12.4 |
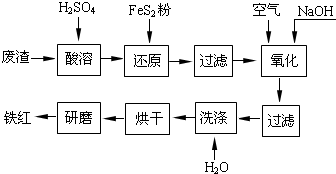
科目:gzhx 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀p H | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
科目:gzhx 来源:广东省期末题 题型:填空题


科目:gzhx 来源:专项题 题型:填空题

(1)铁红的主要成分为__________,还原后过滤得到滤渣的主要成分为_________。
(2)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是_______________________
(3)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式
________________________
(4)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:________________________
(5)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH至3~4,其目的是______________。
科目:gzhx 来源: 题型:
| ||
| ||
| △ |
| ||
| △ |
科目:gzhx 来源: 题型:
| ||
科目:gzhx 来源: 题型:
| ||
| ||
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
科目:gzhx 来源: 题型:阅读理解

| ||
| ||
| △ |
| ||
| △ |
科目:gzhx 来源: 题型:
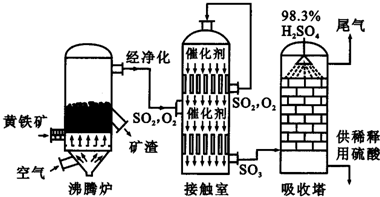
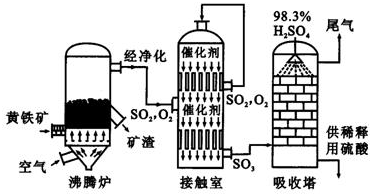
工业上以黄铁矿为原料生产硫酸。
(1)写出燃烧黄铁矿的化学方程式 。
(2)接触室中发生反应的化学方程式是 。
(3)判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔中用浓硫酸吸收三氧化硫而不用水的原因是是 。
(5)吸收塔排出的尾气可以用两种方法处理:
方法①:先用氨水吸收,再用浓硫酸处理。用浓硫酸处理的主要目的是 ;
方法②:先用含一定水的亚硫酸钠吸收后再加热处理,也可达到与方法①相同的目的。为了实现节能减排,其所需能量可以由 提供。与方法①相比,方法②的优点是 。
(6)SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。